olhando mais de perto: Água, O líquido mais importante
Terra é o único corpo conhecido no nosso sistema solar que tem água líquida existente livremente na sua superfície. Isso é bom porque a vida na terra não seria possível sem a presença de água líquida.a água tem várias propriedades que a tornam uma substância única entre as substâncias. É um excelente solvente; dissolve muitas outras substâncias e permite que essas substâncias reajam quando em solução., Na verdade, a água às vezes é chamada de solvente universal por causa dessa capacidade. A água tem pontos de fusão e de ebulição invulgarmente altos (0°C e 100°C, respectivamente) para uma molécula tão pequena. Os pontos de ebulição para moléculas de tamanho semelhante, tais como metano (BP = -162°C) e amônia (BP = -33°C), são mais de 100° menores. Embora um líquido a temperaturas normais, as moléculas de água experimentam uma interação intermolecular relativamente forte que lhes permite manter a fase líquida a temperaturas mais altas do que o esperado.,ao contrário da maioria das substâncias, a forma sólida de água é menos densa do que a sua forma líquida, que permite que o gelo flutue sobre a água. A configuração mais favorável energeticamente das moléculas de H2O é aquela em que cada molécula está ligada ao hidrogênio a quatro moléculas vizinhas. Devido aos movimentos térmicos, este ideal nunca é alcançado no líquido, mas quando a água congela em gelo, as moléculas se estabelecem exatamente neste tipo de arranjo no cristal de gelo., Este arranjo requer que as moléculas estejam um pouco mais distantes do que seria o caso; como consequência, o gelo, no qual a ligação de hidrogênio está no seu máximo, tem uma estrutura mais aberta, e, portanto, uma densidade mais baixa do que a água.,
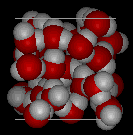
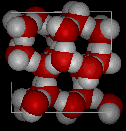
Aqui estão vistas tridimensionais de uma estrutura local típica de água (esquerda) e gelo (direita. Notem a maior abertura da estrutura de gelo que é necessária para garantir o maior grau de ligação de hidrogênio em uma estrutura cristalina uniforme e estendida. A estrutura da água líquida é muito semelhante, mas no líquido, as ligações de hidrogênio são continuamente quebradas e formadas por causa do movimento molecular rápido. Porque o gelo é menos denso que a água líquida, rios, lagos e oceanos congelam de cima para baixo., Na verdade, o gelo forma uma camada de superfície protectora que isola o resto da água, permitindo que peixes e outros organismos sobrevivam nos níveis inferiores de um lago ou mar congelado. Se o gelo fosse mais denso que o líquido, o gelo formado na superfície em tempo frio afundaria tão rápido quanto se formou. Corpos de água congelariam de baixo para cima, o que seria letal para a maioria das criaturas aquáticas. A expansão da água quando o congelamento também explica por que os motores de automóveis ou barcos devem ser protegidos por “anticongelante” e por que os tubos desprotegidos em casas quebram se eles são autorizados a congelar.,a água também requer uma grande quantidade de energia para mudar a temperatura. Enquanto 100 J de energia vai mudar a temperatura de 1 g de Fe em 230 ° C, esta mesma quantidade de energia vai mudar a temperatura de 1 g de H2O em apenas 100 ° C. Assim, a água muda sua temperatura lentamente à medida que o calor é adicionado ou removido. Isso tem um grande impacto sobre o clima, como Sistemas de tempestade como furacões podem ser impactados pela quantidade de calor que a água do oceano pode armazenar.a influência da água no mundo à nossa volta é afectada por estas propriedades., Não é fascinante que uma molécula tão pequena possa ter um impacto tão grande?