Resultados da Aprendizagem
- Derivar o previsto rés-do-estado configurações de elétrons de átomos
- Identificar e explicar as exceções previstas configurações de elétrons para os átomos e íons
- se Relacionam elétron configurações para o elemento classificações na tabela periódica
De ter introduzido os fundamentos de estrutura atômica e da mecânica quântica, podemos usar a nossa compreensão de números quânticos para determinar como orbitais atómicas de se relacionar com o outro., Isso nos permite determinar quais orbitais são ocupados por elétrons em cada átomo. O arranjo específico de elétrons em orbitais de um átomo determina muitas das propriedades químicas desse átomo.
energias orbitais e Estrutura Atômica
a energia dos orbitais atômicos aumenta conforme o número quântico principal, n, aumenta., Em qualquer átomo com dois ou mais elétrons, a repulsão entre os elétrons faz com que as energias do subshells com diferentes valores de l diferentes, de forma que a energia dos orbitais aumenta dentro de um shell na ordem s < p < d < f. A figura 1 mostra como essas duas tendências, o aumento da energia se relacionam. O orbital 1s na parte inferior do diagrama é o orbital com elétrons de menor energia., A energia aumenta à medida que nos movemos para os orbitais 2s e depois 2p, 3s e 3p, mostrando que o valor n crescente tem mais influência na energia do que o valor L crescente para pequenos átomos. No entanto, este padrão não se mantém para átomos maiores. O orbital 3d é maior em energia do que o orbital 4s. Tais sobreposições continuam a ocorrer com frequência à medida que subimos o gráfico.

Figura 1. Diagrama de nível de energia generalizada para orbitais atômicos em um átomo com dois ou mais elétrons (não escalar).,elétrons em átomos sucessivos na tabela periódica tendem a preencher orbitais de baixa energia primeiro. Assim, muitos alunos acham confuso que, por exemplo, os orbitais 5p preenchem imediatamente após o 4d, e imediatamente antes do 6s. a ordem de preenchimento é baseada em resultados experimentais observados, e foi confirmada por cálculos teóricos. Como o número quântico principal, n, aumenta, o tamanho do orbital aumenta e os elétrons passam mais tempo longe do núcleo., Assim, a atração pelo núcleo é mais fraca e a energia associada com o orbital é maior (menos estabilizada). Mas este não é o único efeito que temos de ter em conta. Dentro de cada shell, como o valor de l aumenta, os elétrons são menos penetrantes (o que significa que há menos de elétrons de densidade encontrados perto do núcleo), na ordem em que s > p > d > f., Elétrons que estão mais próximos do núcleo repelem ligeiramente os elétrons que estão mais distantes, compensando ligeiramente as atrações mais dominantes do núcleo elétron–núcleo (lembre-se que todos os elétrons têm cargas -1, mas os núcleos têm cargas +Z). Este fenômeno é chamado de blindagem e será discutido em mais detalhes na próxima seção. Elétrons em orbitais que experimentam mais blindagem são menos estabilizados e, portanto, mais elevados em energia., Para orbitais pequenos (1s A 3p), o aumento de energia devido a n é mais significativo do que o aumento devido a l; no entanto, para orbitais maiores as duas tendências são comparáveis e não podem ser simplesmente previstas. Discutiremos os métodos para recordar a ordem observada.
O arranjo de elétrons nos orbitais de um átomo é chamado de configuração eletrônica do átomo., Podemos descrever um elétron de configuração com um símbolo que contém três partes de informação (Figura 2):
- O número dos principais quantum shell, n,
- A letra que designa o orbital tipo (sub-shell, l), e
- Um número sobrescrito que designa o número de elétrons em uma determinada sub-shell.
Por exemplo, a notação 2p4 (leia–se “dois–p-quatro”) indica quatro elétrons em uma sub-casca p (l = 1) com um número quântico principal (n) de 2. A notação 3d8 (leitura “três–d–oito”) indica oito elétrons na sub-estrutura d (i.e.,, l = 2) da concha principal para a qual n = 3.
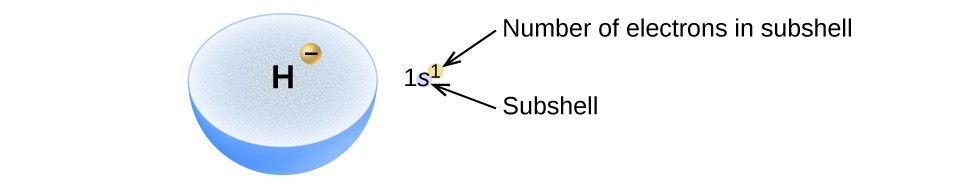
Figura 2. O diagrama de uma configuração eletrônica especifica o subconjunto (valor N E l, com símbolo de letra) e o número de superscript de elétrons.
O Princípio de Aufbau
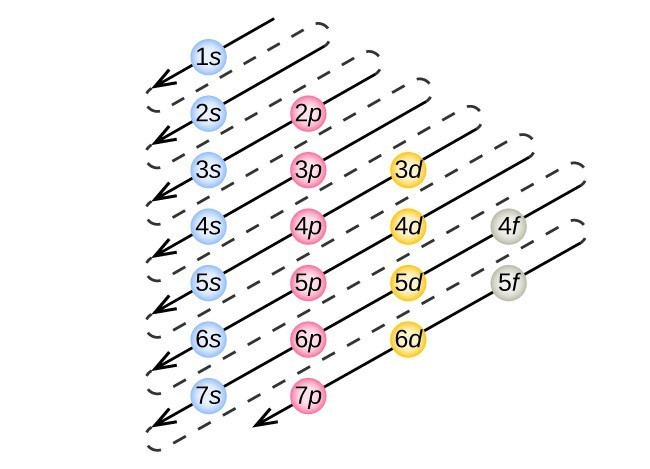
a Figura 3. A seta conduz através de cada sub-resumo na ordem de enchimento apropriada para configurações de elétrons. Este gráfico é simples de construir. Basta fazer uma coluna para todos os orbitais s com cada concha n em uma linha separada., Repita para p, d e F. certifique-se de incluir orbitais permitidos pelos números quânticos (no 1p ou 2d, e assim por diante). Finalmente, desenhar linhas diagonais de cima para baixo como mostrado.
para determinar a configuração dos elétrons para qualquer átomo em particular, podemos “construir” as estruturas na ordem dos números atômicos. Começando com hidrogênio, e continuando através dos períodos da tabela periódica, adicionamos um próton de cada vez para o núcleo e um elétron para a substância adequada até que tenhamos descrito as configurações elétricas de todos os elementos.,este procedimento é chamado de princípio Aufbau, da palavra alemã Aufbau (“construir”). Cada elétron adicionado ocupa o subconjunto da menor energia disponível (na ordem mostrada na Figura 1), sujeito às limitações impostas pelos números quânticos permitidos de acordo com o princípio de exclusão de Pauli. Os electrões entram em sub-células de energia mais elevada apenas depois de sub-células de energia mais baixa terem sido preenchidas até à sua capacidade. A figura 3 ilustra a maneira tradicional de lembrar a ordem de enchimento para orbitais atômicos., Uma vez que a disposição da tabela periódica é baseada nas configurações de elétrons, a Figura 4 fornece um método alternativo para determinar a configuração de elétrons. A ordem de preenchimento simplesmente começa em hidrogênio e inclui cada subconjunto à medida que você avança na ordem Z crescente. Por exemplo, depois de encher o bloco 3p até Ar, vemos que a orbital será 4s (K, Ca), seguido pelos orbitais 3d.
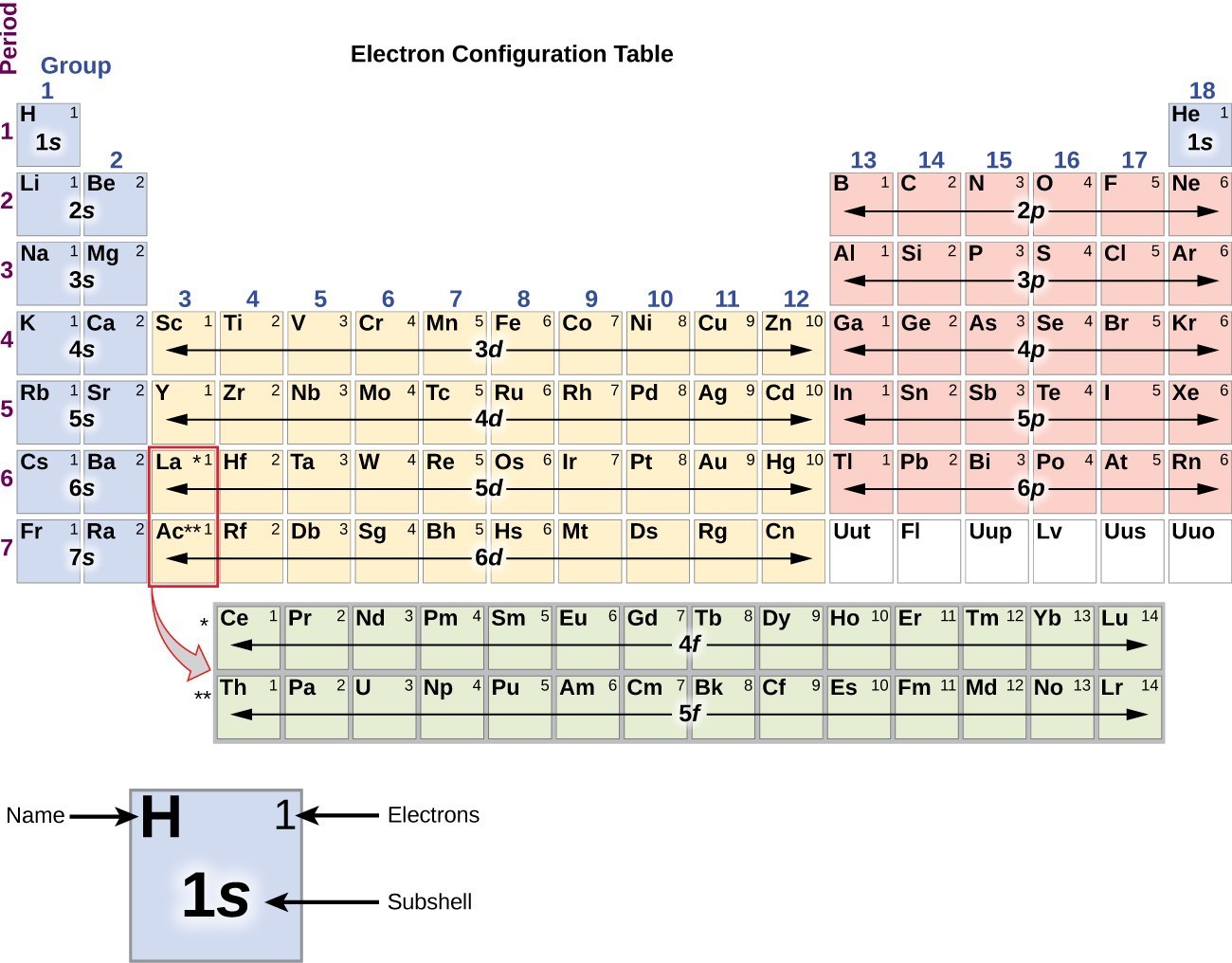
Figura 4. Esta tabela periódica mostra a configuração eletrônica para cada sub-resumo., Ao “construir-se” a partir de hidrogênio, esta tabela pode ser usada para determinar a configuração de elétrons para qualquer átomo na tabela periódica.
vamos agora construir a configuração de elétrons do Estado do solo e diagrama orbital para uma seleção de átomos no primeiro e segundo períodos da tabela periódica. Diagramas orbitais são representações pictóricas da configuração eletrônica, mostrando os orbitais individuais e o arranjo de pares de elétrons. Começamos com um único átomo de hidrogênio (número atômico 1), que consiste de um próton e um elétron., Referindo-se à Figura 3 ou Figura 4, nós esperaríamos encontrar o elétron no orbital 1s. Por convenção, o valor {m}_{s}=+\frac{1}{2} é normalmente preenchido em primeiro lugar. A configuração eletrônica e o diagrama orbital São:
a seguir ao hidrogênio é o gás nobre hélio, que tem um número atômico de 2. O átomo de hélio contém dois prótons e dois elétrons. O primeiro elétron tem os mesmos quatro números quânticos que o elétron do átomo de hidrogênio (n = 1, l = 0, ml = 0, {m}_{s}=+\frac{1}{2} ). O segundo elétron também vai para o orbital 1s e preenche esse orbital., O segundo elétron tem os mesmos números quânticos N, l E ml, mas deve ter o número quântico de spin oposto, {m}_{s}= – \frac{1}{2}. Isto está de acordo com o princípio de exclusão de Pauli: nenhum dois elétrons no mesmo átomo pode ter o mesmo conjunto de quatro números quânticos. Para diagramas orbitais, isso significa que duas setas vão em cada caixa (representando dois elétrons em cada orbital) e as setas devem apontar em direções opostas (representando voltas emparelhadas)., A configuração eletrônica e o diagrama orbital do hélio são:
a camada n = 1 é completamente preenchida em um átomo de hélio.
O átomo seguinte é o lítio de metal alcalino com um número atómico de 3. Os dois primeiros elétrons no lítio preenchem o orbital 1s e têm os mesmos conjuntos de quatro números quânticos que os dois elétrons no hélio. O elétron restante deve ocupar o orbital da próxima energia mais baixa, o orbital 2s (Figura 3 ou Figura 4)., Assim, a configuração eletrônica e orbital diagrama de lítio são:
Um átomo, a terra alcalina de metais berílio, com um número atómico de 4, contém quatro prótons no núcleo e quatro elétrons em torno do núcleo. O quarto elétron preenche o espaço restante no orbital 2s.
um átomo de boro (número atômico 5) contém cinco elétrons. A concha n = 1 é preenchida com dois elétrons e três elétrons ocuparão a concha n = 2., Como qualquer subconjunto s pode conter apenas dois elétrons, o quinto elétron deve ocupar o próximo nível de energia, que será um orbital de 2p. Existem três orbitais 2P degenerados (ml = -1, 0, +1) e o elétron pode ocupar qualquer um destes orbitais p. Ao desenhar diagramas orbitais, incluímos caixas vazias para descrever quaisquer orbitais vazios na mesma subconjunta que estamos preenchendo.

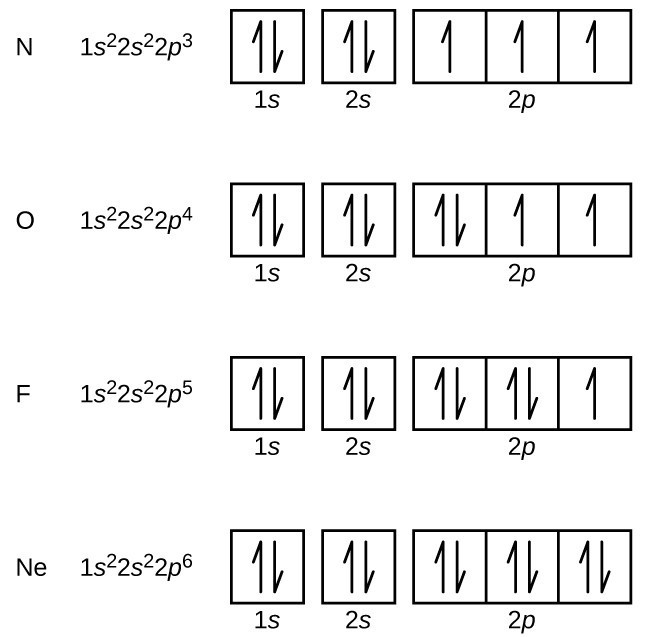
carbono (número atómico 6) tem seis electrões. Quatro deles enchem os orbitais 1 e 2. Os dois elétrons restantes ocupam a camada 2p., Nós agora temos a escolha de encher um dos orbitais 2p e emparelhar os elétrons ou de deixar os elétrons sem emparelhar em dois orbitais p diferentes, mas degenerados. Os orbitais são preenchidos como descrito pela regra de Hund: a configuração de menor energia para um átomo com elétrons dentro de um conjunto de orbitais degenerados é ter o número máximo de elétrons não emparelhados. Assim, os dois elétrons nos orbitais de carbono 2p têm números quânticos N, l E ms idênticos e diferem em seu número quântico ml (de acordo com o princípio de exclusão de Pauli)., A configuração eletrônica e orbital diagrama de carbono são:

de Nitrogênio (número atômico 7) preenche os 1s e 2s subshells e tem um elétron em cada um dos três orbitais 2p, em conformidade com a regra de Hund. Estes três electrões têm voltas não emparelhadas. Oxigênio (número atômico 8) tem um par de elétrons em qualquer um dos orbitais 2p (os elétrons têm spins opostos) e um único elétron em cada um dos outros dois. O flúor (número atômico 9) tem apenas um orbital de 2p contendo um elétron não emparelhado., Todos os elétrons no néon de gás nobre (número atômico 10) são emparelhados, e todos os orbitais no n = 1 e as camadas n = 2 são preenchidos. As configurações de elétrons e diagramas orbitais destes quatro elementos são:
o metal alcalino sódico (número atômico 11) tem mais um elétron do que o átomo de neon. Este elétron deve entrar na sub-estrutura de menor energia disponível, o orbital 3s, dando uma configuração 1s22s22p63s1., Os elétrons que ocupam a camada exterior orbital (s) (maior valor de n) são chamados elétrons de Valência, e aqueles que ocupam a camada interna orbitais são chamados elétrons de núcleo (Figura 5). Uma vez que as conchas de elétrons do núcleo correspondem a configurações de elétrons de gás nobre, podemos abreviar configurações de elétrons escrevendo o gás nobre que corresponde à configuração de elétrons do núcleo, juntamente com os elétrons de Valência em um formato condensado. Para nosso exemplo de sódio, o símbolo representa elétrons do núcleo (1s22s22p6) e nossa configuração abreviada ou condensada é 3s1.,

Figura 5. Uma configuração eletrônica de núcleo abreviada (direita) substitui os elétrons de núcleo com o símbolo de gás nobre cuja configuração corresponde à configuração eletrônica de núcleo do outro elemento.
similarmente, a configuração abreviada do lítio pode ser representada como 2s1, onde representa a configuração do átomo de hélio, que é idêntica à da camada interna cheia de lítio. Escrever as configurações deste modo enfatiza a semelhança das configurações de lítio e sódio., Ambos os átomos, que estão na família de metal alcalino, têm apenas um elétron em uma sub-casca de Valência fora de um conjunto preenchido de conchas internas.
\begin{array}{l}\text{Li:}\left2{s}^{1}\\ \text{An:}\left3{s}^{1}\end{array}
alcalina de metais de terras de magnésio (número atômico 12), com seus 12 elétrons em um 3s2 de configuração, é parecido com o seu membro da família de berílio, 2s2. Ambos os átomos têm uma cápsula s cheia fora das suas conchas internas cheias., O alumínio (número atômico 13), com 13 elétrons e a configuração eletrônica 3s23p1, é análogo ao boro de sua família, 2s22p1.
O elétron configurações de silício (14 elétrons), fósforo (15 de elétrons), enxofre (16 elétrons), cloro (17 elétrons) e argônio (18 elétrons) são análogas nas configurações de elétrons de suas camadas mais externas para o seu correspondente em membros da família do carbono, nitrogênio, oxigênio, flúor e neon, respectivamente, exceto que o principal quantum número da casca exterior de elementos mais pesados aumentou de um para n = 3., A figura 6 mostra a menor energia, ou estado-Solo, configuração eletrônica para estes elementos, bem como para os átomos de cada um dos elementos conhecidos.

Figura 6. Esta versão da tabela periódica mostra a configuração externa de elétrons de cada elemento. Note que para cada grupo, a configuração é muitas vezes semelhante.
quando chegamos ao próximo elemento da tabela periódica, o potássio metálico alcalino (número atômico 19), podemos esperar que começaríamos a adicionar elétrons à sub-casca 3d., No entanto, todas as evidências físicas e químicas disponíveis indicam que o potássio é como lítio e sódio, e que o próximo elétron não é adicionado ao nível 3d, mas é, em vez disso, adicionado ao nível 4s (Figura 6). Como discutido anteriormente, o orbital 3d sem nós radiais é maior em energia porque é menos penetrante e mais protegido do núcleo do que o 4s, que tem três nós radiais. Assim, o potássio tem uma configuração eletrônica de 4s1. Assim, o potássio corresponde a Li e Na em sua configuração de concha de Valência., O próximo elétron é adicionado para completar a sub-casca 4s e o cálcio tem uma configuração eletrônica de 4s2. Isto dá ao cálcio uma configuração externa de electrões correspondente à do berílio e magnésio.
começando com o escândio de metal de transição( número atômico 21), elétrons adicionais são adicionados sucessivamente à sub-casca 3d. Este sub-shell está cheia da sua capacidade com 10 elétrons (lembre-se que para l = 2 , 2l + 1 = 5 valores de ml, o que significa que há cinco orbitais d, que têm uma capacidade combinada de 10 elétrons). A síntese 4p preenche a seguir., Note que para as três séries de elementos, o escândio (Sc) através de cobre (Cu), ítrio (Y) através de prata (Ag), e lutetium (Lu) de ouro (Au), de um total de 10 d elétrons são sucessivamente adicionados ao (n – 1) reservatório próximo ao n shell para trazer o que (n – 1) shell de 8 a 18 elétrons. Para duas séries, lantânio (La), através de lutetium (Lu) e actínio (Ac) através de lawrencium (Lr), 14 f elétrons (l = 3, 2l + 1 = 7 ml de valores; assim, sete orbitais com uma capacidade combinada de 14 elétrons) são sucessivamente adicionados ao (n – 2) shell para trazer o que a shell a partir de 18 de elétrons para um total de 32 elétrons.,
exemplo 1: números quânticos e configurações de elétrons
Qual é a configuração eletrônica e diagrama orbital para um átomo de fósforo? Quais são os quatro números quânticos do último elétron adicionado?
o último elétron adicionado é um elétron de 3p. Portanto, n = 3 e, para um orbital de tipo p, l = 1. O valor de ml pode ser-1, 0 ou +1. Os três orbitais p são degenerados, então qualquer destes valores ml está correto. Para elétrons não emparelhados, a Convenção atribui o valor de +\frac{1}{2} para o número quântico de spin; assim, {m}_{s} = +\frac{1}{2}.,
Verifique a sua aprendizagem
identifique os átomos a partir das configurações de electrões dadas:
- 4s23d5
- 5s24d105p6.
A tabela periódica pode ser uma poderosa ferramenta para predizer a configuração eletrônica de um elemento. No entanto, encontramos exceções à ordem de enchimento de orbitais que são mostradas na Figura 3 ou na Figura 4., Por exemplo, as configurações de elétrons (mostradas na Figura 6) dos metais de transição crómio (Cr; número atômico 24) e cobre (Cu; número atômico 29), entre outros, não são aquelas que nós esperaríamos. Em geral, tais exceções envolvem sub-células com energia muito semelhante, e pequenos efeitos podem levar a mudanças na ordem de enchimento.
no caso de Cr e Cu, descobrimos que sub-células semi-cheias e completamente cheias aparentemente representam condições de estabilidade preferida., Esta estabilidade é tal que um elétron se desloca do 4s para o orbital 3d para ganhar a estabilidade extra de uma subshell 3d Semi-cheia (em Cr) ou uma subshell 3d cheia (em Cu). Outras exceções também ocorrem. Por exemplo, o nióbio (Nb, número atômico 41) é previsto para ter a configuração eletrônica 5s24d3. Experimentalmente, observamos que sua configuração eletrônica de Estado-solo é na verdade 5s14d4., Nós podemos racionalizar esta observação dizendo que as repulsões elétron–elétrons experimentadas por emparelhar os elétrons no orbital 5s são maiores do que a diferença de energia entre os orbitais 5s e 4d. Não há um método simples para prever as exceções para átomos onde a magnitude das repulsões entre elétrons é maior do que as pequenas diferenças de energia entre sub-células.,
Configurações de Elétrons e a Tabela Periódica
Conforme descrito anteriormente, a tabela periódica organiza os átomos com base no aumento do número atômico, de modo que os elementos com as mesmas propriedades químicas se repetem periodicamente. Quando suas configurações de elétrons são adicionadas à tabela (Figura 6), também vemos uma recorrência periódica de Configurações similares de elétrons nas camadas exteriores destes elementos. Por estarem nas camadas exteriores de um átomo, os elétrons de Valência desempenham o papel mais importante nas reações químicas., Os elétrons externos têm a maior energia dos elétrons em um átomo e são mais facilmente perdidos ou compartilhados do que os elétrons do núcleo. Elétrons de Valência são também o fator determinante em algumas propriedades físicas dos elementos.os metais alcalinos lítio e sódio têm apenas um elétron de Valência, os metais alcalinos terrestres berílio e magnésio têm dois, e os halogéneos flúor e cloro têm sete elétrons de Valência., A similaridade em Propriedades químicas entre elementos do mesmo grupo ocorre porque eles têm o mesmo número de elétrons de Valência. É a perda, ganho ou compartilhamento de elétrons de Valência que define como os elementos reagem.
é importante lembrar que a tabela periódica foi desenvolvida com base no comportamento químico dos elementos, bem antes de qualquer idéia de sua estrutura atômica estava disponível. Agora podemos entender por que a tabela periódica tem o arranjo que tem—o arranjo coloca elementos cujos átomos têm o mesmo número de elétrons de Valência no mesmo grupo., Este arranjo é enfatizado na Figura 6, que mostra em forma de tabela periódica a configuração eletrônica da última subconjunta a ser preenchida pelo princípio Aufbau. As seções coloridas da Figura 6 mostram as três categorias de elementos classificados pelos orbitais que estão sendo preenchidos: grupo principal, transição e elementos de transição interna. Estas classificações determinam quais orbitais são contados na concha de Valência, ou orbitais de maior nível de energia de um átomo.,
- Os Elementos principais do grupo (às vezes chamados de elementos representativos) são aqueles em que o último elétron adicionado entra em um orbital s ou p na concha mais externa, mostrado em azul e vermelho na Figura 6. Esta categoria inclui todos os elementos não metálicos, bem como muitos metais e os elementos intermédios semimetálicos. Os elétrons de Valência para os elementos principais do grupo são aqueles com o nível n mais alto. Por exemplo, gálio (Ga, número atômico 31) tem a configuração eletrônica 4s23d104p1, que contém três elétrons de Valência (sublinhado)., Os orbitais d completamente cheios contam como núcleo, não como Valência, elétrons.elementos de transição ou metais de transição. Estes são elementos metálicos nos quais o último elétron adicionado entra em um orbital d. Os elétrons de Valência (aqueles adicionados após a última configuração de gases nobres) nestes elementos incluem os elétrons ns e (n – 1) d. A definição oficial do IUPAC de elementos de transição especifica aqueles com orbitais d parcialmente cheios. Assim, os elementos com orbitais completamente cheios (Zn, Cd, Hg, bem como Cu, Ag, e Au na Figura 6) não são elementos tecnicamente de transição., No entanto, o termo é frequentemente usado para se referir a todo o bloco d (amarelo colorido na Figura 6), e vamos adotar este uso neste manual.elementos de transição interna são elementos metálicos nos quais o último elétron adicionado ocupa um orbital F. Eles são mostrados em verde na Figura 6. As conchas de Valência dos elementos de transição interna consistem no (n – 2)f, no (n-1)d, e nas sub-células ns., Há dois interna de transição de série:
- O lantanídeos série: lantanídeos (La) através de lutetium (Lu)
- O actinídeos série: actinídeos (Ac) através de lawrencium (Lr)
Lantânio e actínio, por causa de suas semelhanças com os outros membros da série, estão incluídas e utilizado para o nome da série, mesmo que eles são metais de transição com nenhum f elétrons.
configurações de elétrons de íons
vimos que íons são formados quando átomos ganham ou perdem elétrons., Um cátion (íon carregado positivamente) forma-se quando um ou mais elétrons são removidos de um átomo pai. Para os elementos principais do grupo, os elétrons que foram adicionados por último são os primeiros elétrons removidos. Para metais de transição e metais de transição interna, no entanto, elétrons no orbital s são mais fáceis de remover do que os elétrons d ou f, E assim os elétrons ns mais altos são perdidos, e então os elétrons (n – 1)D ou (n – 2)f são removidos. Um ânion (íon carregado negativamente) forma-se quando um ou mais elétrons são adicionados a um átomo pai. Os elétrons adicionados preenchem a ordem prevista pelo princípio de Aufbau.,
Exemplo 2: Previsão de Elétrons Configurações de Íons
Qual é a configuração eletrônica e orbital diagrama de:
- Na+
- P3–
- Al2+
- Fe2+
- Sm3+
Verifique a sua aprendizagem
Qual ião com uma carga +2 tem a configuração electrónica 1s22s22p63s23p63d104s24p64d5? Qual íon com carga +3 tem esta configuração?
os Conceitos-Chave e Resumo
A relativa a energia do subshells determinar a ordem em que os orbitais atómicas são preenchidos (1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, e assim por diante)., Configurações de elétrons e diagramas orbitais podem ser determinados aplicando o princípio de exclusão de Pauli (nenhum dois elétrons pode ter o mesmo conjunto de quatro números quânticos) e a regra de Hund (sempre que possível, elétrons retêm spins não emparelhados em orbitais degenerados).elétrons de Valência são responsáveis pela maior parte do comportamento químico dos elementos. Na tabela periódica, elementos com configurações análogas de elétrons de Valência geralmente ocorrem dentro do mesmo grupo., Existem algumas exceções à ordem de enchimento prevista, particularmente quando orbitais semi-cheios ou completamente cheios podem ser formados. A tabela periódica pode ser dividida em três categorias baseadas no orbital em que o último elétron a ser adicionado é colocado: elementos do grupo principal (orbitais s e p), elementos de transição (orbitais d), e elementos de transição interna (orbitais f).
Tentar
- Leia os rótulos de vários produtos comerciais e identificar íons monoatômicos de, pelo menos, quatro elementos de transição contida nos produtos., Escreva as configurações completas de elétrons destes catiões.lêem os rótulos de vários produtos comerciais e identificam iões monoatómicos de, pelo menos, seis elementos principais do grupo contidos nos produtos. Escreva as configurações completas de elétrons destes catiões e aniões.,
- completo Usando sub-shell notação (não abreviaturas, 1s22s22p6, e assim por diante), prever a configuração eletrônica de cada um dos seguintes átomos:
- C
- P
- V
- Sb
- Sm
- completo Usando sub-shell notação (1s22s22p6, e assim por diante), prever a configuração eletrônica de cada um dos seguintes átomos:
- N
- Si
- Fe
- Te
- Tb
- É 1s22s22p6 o símbolo para uma propriedade macroscópica ou microscópica de propriedade de um elemento? Explique a sua resposta.,que informações adicionais precisamos para responder à pergunta “qual íon tem a configuração eletrônica 1s22s22p63s23p6”?,
- Desenhar o diagrama de orbital para a valence shell de cada um dos seguintes átomos:
- C
- P
- V
- Sb
- Ru
- Use um orbital diagrama para descrever a configuração eletrônica do valence shell de cada um dos seguintes átomos:
- N
- Si
- Fe
- Te
- Mo
- completo Usando sub-shell notação (1s22s22p6, e assim por diante), prever o elétron configurações dos seguintes íons.,
- N3
- Ca2+
- S–
- Cs2+
- Cr2+
- Gd3+
- Que o átomo tem a configuração eletrônica 1s22s22p63s23p64s23d104p65s24d2?que átomo tem a configuração electrónica 1s22s22p63s23p63d74s2?
- Qual íon com carga +1 tem a configuração eletrônica 1s22s22p63s23p63d104s24p6? Qual íon com carga a -2 tem esta configuração?qual dos seguintes átomos contém apenas três elétrons de Valência: Li, B, N, F, Ne?qual dos seguintes tem dois electrões não emparelhados?,
- Mg
- Si
- S
- Ambos Mg e S
- Ambos Si e S.
- Que o átomo seria de esperar para ter uma semi-preenchido 6p sub-shell?qual é o átomo que se espera que tenha uma subtileza 4s semi-cheia?numa área da Austrália, o gado não prosperou apesar da presença de forragem adequada. Uma investigação revelou a causa da ausência de cobalto suficiente no solo. Cobalto forma catiões em dois estados de oxidação, Co2+ e Co3+. Escreva a estrutura eletrônica dos dois catiões.,o tálio foi usado como veneno na história misteriosa de Agatha Christie “o cavalo pálido”.”O tálio tem duas formas catiônicas possíveis, +1 e + 3. Os compostos +1 são mais estáveis. Escrever a estrutura eletrônica do cátion +1 de tálio.
- Escrever o elétron configurações para os seguintes átomos ou íons:
- B3+
- S–
- Cl3+
- Ca2+
- Ti
- Cobalto–60 e o iodo–131 são isótopos radioativos comumente usados em medicina nuclear. Quantos protões, neutrões e electrões existem nos átomos destes isótopos?, Write the complete electron configuration for each isotope.
- Write a set of quantum numbers for each of the electrons with an n of 3 in a Sc atom.




