Cómo sabían?
la geometría tetraédrica del carbono se predijo ya en 1874. ¿Pero cómo lo supieron? Surgió una pregunta al analizar el etano con un sustituyente de bromo (C2H5Br). Al mirar las posibles estructuras del compuesto C2H5Br hay varias fórmulas estructurales posibles.aquí había un problema serio en cuanto a si estas fórmulas representan los mismos compuestos o diferentes., Todo lo que se sabía en los primeros días era que cada muestra purificada de C2H5Br, sin importar cuán preparada, tenía un punto de ebullición de 38 oC y una densidad de 1.460 gml−1. Además, todos parecían iguales, todos olían igual, y todos sufrieron las mismas reacciones químicas. No había pruebas de que C2H5Br fuera una mezcla o de que se pudiera preparar más de un compuesto de esta fórmula. Uno podría concluir, por lo tanto, que todas las fórmulas estructurales anteriores representan una sola sustancia, pero ¿cómo? Una solución brillante al problema llegó cuando J. H., van’t Hoff propuso que los cuatro enlaces de carbono son equivalentes y dirigidos a las esquinas de un tetraedro regular. Si redibujamos las estructuras para C2H5Br con ambos carbonos que tienen Geometría tetraédrica, vemos que solo hay una disposición posible. Esta teoría sugiere la idea de la rotación libre alrededor de los enlaces sigma que se discutirá más adelante.
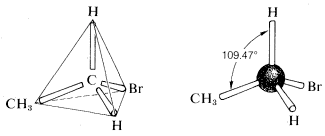
hubo un serio problema en cuanto a si estas fórmulas representan la misma o de diferentes compuestos., Todo lo que se sabía en los primeros días era que cada muestra purificada de C2H5Br, sin importar cuán preparada, tenía un punto de ebullición de 38 oC y una densidad de 1.460 gml−1. Además, todos parecían iguales, todos olían igual, y todos sufrieron las mismas reacciones químicas. No había pruebas de que C2H5Br fuera una mezcla o de que se pudiera preparar más de un compuesto de esta fórmula. Uno podría concluir, por lo tanto, que todas las fórmulas estructurales anteriores representan una sola sustancia, pero ¿cómo? Una solución brillante al problema llegó cuando J. H., van’t Hoff propuso que los cuatro enlaces de carbono son equivalentes y dirigidos a las esquinas de un tetraedro regular. Si redibujamos las estructuras para C2H5Br con ambos carbonos que tienen Geometría tetraédrica, vemos que solo hay una disposición posible. Esta teoría sugiere la idea de la rotación libre alrededor de los enlaces sigma que se discutirá más adelante.
