mirando más de cerca: agua, el líquido más importante
La Tierra es el único cuerpo conocido en nuestro sistema solar que tiene agua líquida existente libremente en su superficie. Eso es algo bueno porque la vida en la Tierra no sería posible sin la presencia de agua líquida.
el agua tiene varias propiedades que la convierten en una sustancia única entre las sustancias. Es un excelente disolvente; disuelve muchas otras sustancias y permite que esas sustancias reaccionen cuando están en solución., De hecho, el agua a veces se llama el solvente universal debido a esta capacidad. El agua tiene puntos de fusión y ebullición inusualmente altos (0 ° C y 100°C, respectivamente) para una molécula tan pequeña. Los puntos de ebullición para moléculas de tamaño similar, como el metano (BP = -162°C) y el amoníaco (BP = -33°C), son más de 100° más bajos. Aunque es un líquido a temperaturas normales, las moléculas de agua experimentan una interacción intermolecular relativamente fuerte que les permite mantener la fase líquida a temperaturas más altas de lo esperado.,
a diferencia de la mayoría de las sustancias, la forma sólida del agua es menos densa que su forma líquida, lo que permite que el hielo flote en el agua. La configuración energéticamente más favorable de las moléculas de H2O es una en la que cada molécula está unida por hidrógeno a cuatro moléculas vecinas. Debido a los movimientos térmicos, este ideal nunca se logra en el líquido, pero cuando el agua se congela en hielo, las moléculas se asientan exactamente en este tipo de disposición en el cristal de hielo., Esta disposición requiere que las moléculas estén algo más separadas de lo que sería el caso; como consecuencia, el hielo, en el que el enlace de hidrógeno está en su máximo, tiene una estructura más abierta, y por lo tanto una densidad menor que el agua.,
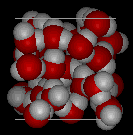
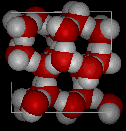
Aquí hay vistas tridimensionales de una estructura local típica de agua (izquierda) y hielo (derecha.) Observe la mayor apertura de la estructura de hielo que es necesaria para asegurar el grado más fuerte de enlace de hidrógeno en una red cristalina uniforme y extendida. La estructura del agua líquida es muy similar, pero en el líquido, los enlaces de hidrógeno se rompen continuamente y se forman debido al rápido movimiento molecular. Debido a que el hielo es menos denso que el agua líquida, los ríos, lagos y océanos se congelan de arriba hacia abajo., De hecho, el hielo forma una capa superficial protectora que aísla el resto del agua, permitiendo que los peces y otros organismos sobrevivan en los niveles más bajos de un lago o mar congelado. Si el hielo fuera más denso que el líquido, el hielo formado en la superficie en clima frío se hundiría tan rápido como se formó. Los cuerpos de agua se congelarían de abajo hacia arriba, lo que sería letal para la mayoría de las criaturas acuáticas. La expansión del agua al congelarse también explica por qué los motores de automóviles o barcos deben estar protegidos por «anticongelante» y por qué las tuberías desprotegidas en las casas se rompen si se les permite congelarse.,
el agua también requiere una cantidad inusualmente grande de energía para cambiar la temperatura. Mientras que 100 J de energía cambiará la temperatura de 1 g de Fe en 230°C, esta misma cantidad de energía cambiará la temperatura de 1 g de H2O en solo 100°C. Por lo tanto, el agua Cambia su temperatura lentamente a medida que se agrega o elimina calor. Esto tiene un gran impacto en el clima, ya que los sistemas de tormentas como los huracanes pueden verse afectados por la cantidad de calor que el agua del océano puede almacenar.
la influencia del agua en el mundo que nos rodea se ve afectada por estas propiedades., ¿No es fascinante que una molécula tan pequeña pueda tener un impacto tan grande?