hasta ahora, todas nuestras reacciones han tenido lugar en condiciones ideales. Sin embargo, las condiciones ideales no existen en la vida real. Los reactivos pueden ser impuros, las reacciones pueden no completarse, o las reacciones dadas pueden tener que competir con varias reacciones secundarias más pequeñas. De hecho, en el laboratorio, si obtienes el 60% de la cantidad esperada de Producto, eso se considera muy bueno.
ahora, hablemos de terminología. La cantidad calculada o esperada de producto se denomina rendimiento teórico., La cantidad de producto realmente producido se llama el rendimiento real. Cuando se divide el rendimiento real por el rendimiento teórico se obtiene un porcentaje decimal conocido como el rendimiento porcentual de una reacción.
Rendimiento porcentual = 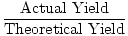 |
una Vez más, es hora de un problema de ejemplo:
Problema: ¿Cuál es el rendimiento porcentual de la reacción siguiente si el 60 gramos de CaCO3 se calienta a dar 15 gramos de CaO?,
| CaCO3→CaO + CO2 |
Solución: lo Ideal sería, ¿cuántos gramos de CaO debe ser producido? Primero verifique que la ecuación esté equilibrada; lo es. Ahora convertir a moles, basado en la cantidad de CaCO3 presente.
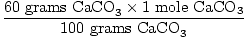 × ×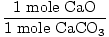 = 0.6 mol CaO = 0.6 mol CaO |
¿cuántos gramos es esto?,
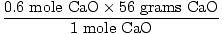 = 33.6 gramos de CaO = 33.6 gramos de CaO |
Así que, idealmente, 33.6 gramos de CaO debe haber sido producida en esta reacción. Este es el rendimiento teórico. Sin embargo, el problema nos dice que solo se produjeron 15 gramos. 15 gramos es el rendimiento real. Ahora es un asunto simple encontrar el rendimiento porcentual.