comment le savaient-ils?
la géométrie tétraédrique du carbone a été prédite dès 1874. Mais comment ont-ils su? Une question s’est posée en regardant l’éthane avec un substituant de brome (C2H5Br). En regardant les structures possibles du composé C2H5Br, il existe plusieurs formules structurelles possibles.il y avait un problème sérieux quant à savoir si ces formules représentent les mêmes composés ou des composés différents., Tout ce qui était connu dans les premiers jours était que chaque échantillon purifié de C2H5Br, peu importe comment préparé, avait un point d’ébullition de 38 oC et une densité de 1.460 gml−1. De plus, tous se ressemblaient, tous sentaient la même chose et subissaient tous les mêmes réactions chimiques. Il n’y avait aucune preuve que C2H5Br était un mélange ou que plus d’un composé de cette formule pouvait être préparé. On pourrait donc conclure que toutes les formules structurelles ci-dessus représentent une seule substance, mais comment? Une solution brillante au problème est venue lorsque J. H., van’t Hoff a proposé que les quatre liaisons du carbone soient équivalentes et dirigées vers les coins d’un tétraèdre régulier. Si nous redessinons les structures pour C2H5Br avec les deux carbones ayant une géométrie tétraédrique, nous voyons qu’il n’y a qu’un seul arrangement possible. Cette théorie fait allusion à l’idée de rotation libre autour des liaisons sigma qui sera discutée plus tard.
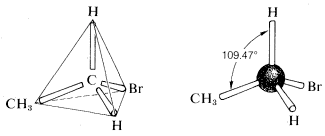
Il y a un sérieux problème quant à savoir si ces formules représentent les mêmes ou différents composés., Tout ce qui était connu dans les premiers jours était que chaque échantillon purifié de C2H5Br, peu importe comment préparé, avait un point d’ébullition de 38 oC et une densité de 1.460 gml−1. De plus, tous se ressemblaient, tous sentaient la même chose et subissaient tous les mêmes réactions chimiques. Il n’y avait aucune preuve que C2H5Br était un mélange ou que plus d’un composé de cette formule pouvait être préparé. On pourrait donc conclure que toutes les formules structurelles ci-dessus représentent une seule substance, mais comment? Une solution brillante au problème est venue lorsque J. H., van’t Hoff a proposé que les quatre liaisons du carbone soient équivalentes et dirigées vers les coins d’un tétraèdre régulier. Si nous redessinons les structures pour C2H5Br avec les deux carbones ayant une géométrie tétraédrique, nous voyons qu’il n’y a qu’un seul arrangement possible. Cette théorie fait allusion à l’idée de rotation libre autour des liaisons sigma qui sera discutée plus tard.
