regarder de plus près: L’eau, le liquide le plus Important
La Terre est le seul corps connu dans notre système solaire qui a de l’eau liquide existant librement à sa surface. C’est une bonne chose car la vie sur Terre ne serait pas possible sans la présence d’eau liquide.
l’eau a plusieurs propriétés qui en font une substance unique parmi les substances. C’est un excellent solvant; il dissout de nombreuses autres substances et permet à ces substances de réagir lorsqu’elles sont en solution., En fait, l’eau est parfois appelée le solvant universel en raison de cette capacité. L’eau a des points de fusion et d’ébullition inhabituellement élevés (0°C et 100°C, respectivement) pour une molécule aussi petite. Les points d’ébullition pour des molécules de taille similaire, telles que le méthane (BP = -162°C) et l’ammoniac (BP = -33°C), sont inférieurs de plus de 100°. Bien qu’un liquide à des températures normales, les molécules d’eau connaissent une interaction intermoléculaire relativement forte qui leur permet de maintenir la phase liquide à des températures plus élevées que prévu.,
Contrairement à la plupart des substances, la forme solide de l’eau est moins dense que sa forme liquide, ce qui permet de glace à flotter sur l’eau. La configuration la plus favorable sur le plan énergétique des molécules de H2O est celle dans laquelle chaque molécule est liée à l’hydrogène à quatre molécules voisines. En raison des mouvements thermiques, cet idéal n’est jamais atteint dans le liquide, mais lorsque l’eau gèle à la glace, les molécules se déposent exactement dans ce genre d’arrangement dans le cristal de glace., Cette disposition exige que les molécules soient un peu plus éloignées les unes des autres que ce ne serait le cas; en conséquence, la glace, dans laquelle la liaison hydrogène est à son maximum, a une structure plus ouverte, et donc une densité plus faible que l’eau.,
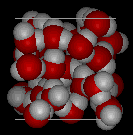
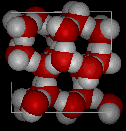
Voici des vues en trois dimensions d’une structure locale typique de l’eau (à gauche) et de la glace (à droite.) Notez la plus grande ouverture de la structure de glace qui est nécessaire pour assurer le plus fort degré de liaison hydrogène dans un réseau cristallin uniforme et étendu. La structure de l’eau liquide est très similaire, mais dans le liquide, les liaisons hydrogène sont continuellement brisées et formées en raison d’un mouvement moléculaire rapide. Parce que la glace est moins dense que l’eau liquide, les rivières, les lacs et les océans gèlent de haut en bas., En fait, la glace forme une couche de surface protectrice qui isole le reste de l’eau, permettant aux poissons et autres organismes de survivre dans les niveaux inférieurs d’un lac ou d’une mer gelée. Si la glace était plus dense que le liquide, la glace formée à la surface par temps froid coulerait aussi vite qu’elle s’est formée. Les plans d’eau gèleraient de bas en haut, ce qui serait mortel pour la plupart des créatures aquatiques. L’expansion de l’eau lors du gel explique également pourquoi les moteurs d’automobiles ou de bateaux doivent être protégés par « antigel” et pourquoi les tuyaux non protégés dans les maisons se brisent s’ils sont autorisés à geler.,
L’eau nécessite également une quantité inhabituellement importante d’énergie pour changer de température. Alors que 100 J d’énergie modifieront la température de 1 g de Fe de 230°C, cette même quantité d’énergie modifiera la température de 1 g de H2O de seulement 100°C. Ainsi, l’eau change lentement de température à mesure que la chaleur est ajoutée ou retirée. Cela a un impact majeur sur la météo, car les systèmes de tempête comme les ouragans peuvent être affectés par la quantité de chaleur que l’eau de mer peut stocker.
l’influence de l’eau sur le monde qui nous entoure est affectée par ces propriétés., N’est-il pas fascinant qu’une si petite molécule puisse avoir un impact aussi important?