résultats D’apprentissage
- dériver les configurations d’électrons à l’état fondamental prédites des atomes
- identifier et expliquer les exceptions aux configurations d’électrons prédites pour les atomes et les ions
- relier les configurations d’électrons aux classifications nombres pour déterminer comment les orbitales atomiques se rapportent les unes aux autres., Cela nous permet de déterminer quelles orbitales sont occupées par des électrons dans chaque atome. La disposition spécifique des électrons dans les orbitales d’un atome détermine de nombreuses propriétés chimiques de cet atome.
énergies orbitales et Structure atomique
l’énergie des orbitales atomiques augmente à mesure que le nombre quantique principal, n, augmente., Dans tout atome avec deux électrons ou plus, la répulsion entre les électrons fait que les énergies des sous-cellules avec des valeurs différentes de l diffèrent de sorte que l’énergie des orbitales augmente à l’intérieur d’une coquille dans l’ordre s < p < d < F. La Figure 1 montre comment ces deux tendances L’orbitale 1s au bas du diagramme des orbitales avec des électrons de faible énergie., L’énergie augmente à mesure que nous nous déplaçons vers les orbitales 2s, puis 2p, 3s et 3p, montrant que la valeur croissante de n a plus d’influence sur l’énergie que la valeur croissante de l pour les petits atomes. Cependant, ce modèle ne tient pas pour les atomes plus gros. L’orbitale 3d est plus énergétique que l’orbitale 4s. De tels chevauchements continuent de se produire fréquemment lorsque nous remontons le graphique.

la Figure 1. Diagramme de niveau d’énergie généralisé pour les orbitales atomiques dans un atome avec deux électrons ou plus (pas à l’échelle).,
Les électrons dans les atomes successifs du tableau périodique ont tendance à remplir les orbitales de faible énergie en premier. Ainsi, de nombreux étudiants trouvent déroutant que, par exemple, les orbitales 5p se remplissent immédiatement après le 4d et immédiatement avant le 6s. l’ordre de remplissage est basé sur les résultats expérimentaux observés et a été confirmé par des calculs théoriques. À mesure que le nombre quantique principal, n, augmente, la taille de l’orbitale augmente et les électrons passent plus de temps plus loin du noyau., Ainsi, l’attraction vers le noyau est plus faible et l’énergie associée à l’orbitale est plus élevée (moins stabilisée). Mais ce n’est pas le seul effet que nous devons prendre en compte. Dans chaque enveloppe, à mesure que la valeur de l augmente, les électrons sont moins pénétrants (ce qui signifie qu’il y a moins de densité électronique trouvée près du noyau), dans l’ordre s > p > d > F., Les électrons qui sont plus proches du noyau repoussent légèrement les électrons qui sont plus éloignés, compensant légèrement les attractions électron-noyau les plus dominantes (rappelez-vous que tous les électrons ont des charges -1, mais les noyaux ont des charges +Z). Ce phénomène est appelé blindage et sera discuté plus en détail dans la section suivante. Les électrons dans les orbitales qui subissent plus de blindage sont moins stabilisés et donc plus énergétiques., Pour les petites orbitales (1s à 3p), l’augmentation de l’énergie due à n est plus significative que l’augmentation due à l; cependant, pour les orbitales plus grandes, les deux tendances sont comparables et ne peuvent pas être simplement prédites. Nous discuterons des méthodes pour se souvenir de l’ordre observé.
L’arrangement des électrons dans les orbitales d’un atome est appelée la configuration électronique de l’atome., Nous décrivons une configuration d’électrons avec un symbole qui contient trois informations (Figure 2):
- Le nombre de la coquille quantique principale, n,
- La lettre qui désigne le type orbital (la sous-coquille, l), et
- un nombre en exposant qui désigne le nombre d’électrons dans cette sous-coquille particulière.
par exemple, la notation 2p4 (lire « deux–p–quatre”) indique quatre électrons dans une sous-enveloppe p (l = 1) avec un nombre quantique principal (n) de 2. La notation 3d8 (lire « trois–d–huit”) indique huit électrons dans la sous-coque d (c’est-à-dire,, l = 2) de la coquille principale pour laquelle n = 3.
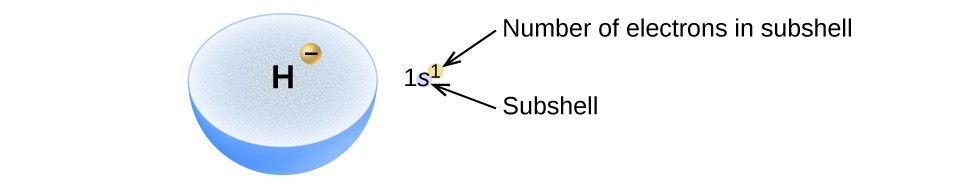
la Figure 2. Le diagramme d’une configuration d’électrons spécifie la sous-coquille (valeur n et l, avec symbole de lettre) et le nombre d’électrons en exposant.
Le Principe Aufbau
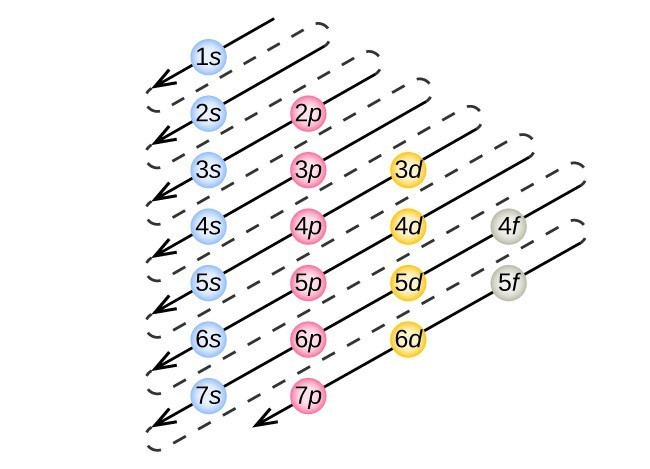
la Figure 3. La flèche traverse chaque sous-coque dans l’ordre de remplissage approprié pour les configurations d’électrons. Ce graphique est simple à construire. Créez simplement une colonne pour toutes les orbitales s avec chaque shell n sur une ligne séparée., Répétez pour p, d et F. assurez-vous d’inclure uniquement les orbitales autorisées par les nombres quantiques (pas de 1p ou 2d, etc.). Enfin, tracez des lignes diagonales de haut en bas comme indiqué.
pour déterminer la configuration électronique pour un atome particulier, nous pouvons « construire” les structures dans l’ordre des nombres atomiques. En commençant par l’hydrogène, et en continuant à travers les périodes du tableau périodique, nous ajoutons un proton à la fois au noyau et un électron à la sous-coquille appropriée jusqu’à ce que nous ayons décrit les configurations électroniques de tous les éléments.,
Cette procédure est appelée le principe Aufbau, du mot allemand Aufbau (« construire”). Chaque électron ajouté occupe la sous-enveloppe de la plus faible énergie disponible (dans l’ordre représenté sur la Figure 1), sous réserve des limitations imposées par les nombres quantiques autorisés selon le principe D’exclusion de Pauli. Les électrons entrent dans les sous-cellules de plus haute énergie seulement après que les sous-cellules de plus basse énergie ont été remplies à pleine capacité. La Figure 3 illustre la façon traditionnelle de mémoriser l’ordre de remplissage des orbitales atomiques., Étant donné que la disposition du tableau périodique est basée sur les configurations d’électrons, la Figure 4 fournit une méthode alternative pour déterminer la configuration d’électrons. L’ordre de remplissage commence simplement à l’hydrogène et inclut chaque sous-coque au fur et à mesure que vous procédez dans l’ordre croissant Z. Par exemple, après avoir rempli le bloc 3p Jusqu’à Ar, nous voyons que l’orbitale sera 4s (K, Ca), suivie des orbitales 3d.
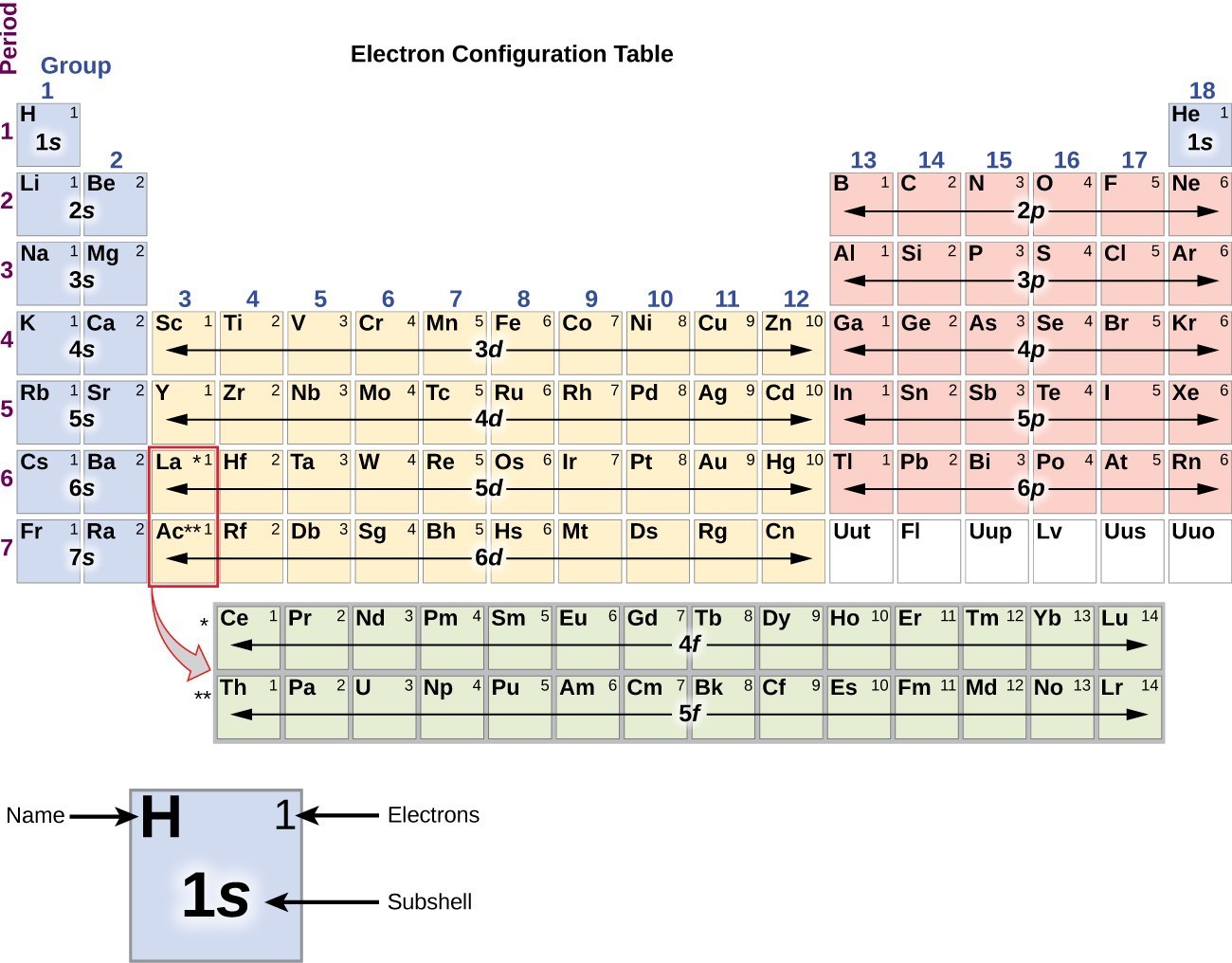
la Figure 4. Ce tableau périodique montre la configuration électronique de chaque sous-enveloppe., En « construisant » à partir d’hydrogène, ce tableau peut être utilisé pour déterminer la configuration électronique pour n’importe quel atome du tableau périodique.
Nous allons maintenant construire la configuration électronique à l’état fondamental et le diagramme orbital pour une sélection d’atomes dans les première et deuxième périodes du tableau périodique. Les diagrammes orbitaux sont des représentations picturales de la configuration électronique, montrant les orbitales individuelles et la disposition d’appariement des électrons. Nous commençons par un seul atome d’hydrogène (numéro atomique 1), composé d’un proton et d’un électron., Se référant à la Figure 3 et Figure 4, nous nous attendrions à trouver l’électron dans l’orbitale 1s. Par convention, la valeur {m}_{s}= + \frac{1}{2} est généralement remplie en premier. La configuration électronique et le diagramme orbital sont:

suivant l’hydrogène est l’hélium de gaz noble, qui a un numéro atomique de 2. L’atome d’hélium contient deux protons et deux électrons. Le premier électron a le même quatre nombres quantiques que l’atome d’hydrogène d’électrons (n = 1, l = 0, ml = 0, {m}_{s}=+\frac{1}{2} ). Le deuxième électron entre également dans l’orbitale 1s et remplit cette orbitale., Le deuxième électron a les mêmes nombres quantiques n, l et ml, mais doit avoir le nombre quantique de spin opposé, {m}_{s}=-\frac{1}{2}. Ceci est en accord avec le principe D’exclusion de Pauli: aucun deux électrons dans le même atome ne peut avoir le même ensemble de quatre nombres quantiques. Pour les diagrammes orbitaux, cela signifie que deux flèches vont dans chaque case (représentant deux électrons dans chaque orbitale) et les flèches doivent pointer dans des directions opposées (représentant des spins appariés)., La configuration électronique et le diagramme orbital de l’hélium sont:

la coquille n = 1 est complètement remplie d’un atome d’hélium.
l’atome suivant est le métal alcalin lithium avec un numéro atomique de 3. Les deux premiers électrons du lithium remplissent l’orbitale 1s et ont les mêmes ensembles de quatre nombres quantiques que les deux électrons de l’hélium. L’électron restant doit occuper l’orbitale de l’énergie la plus basse suivante, l’orbitale 2s (Figure 3 ou Figure 4)., Ainsi, la configuration électronique et le diagramme orbital du lithium sont:

un atome du métal alcalino-terreux béryllium, avec un numéro atomique de 4, contient quatre protons dans le noyau et quatre électrons entourant le noyau. Le quatrième électron remplit l’espace restant dans l’orbitale 2s.

Un atome de bore (de numéro atomique 5) contient cinq électrons. La coquille n = 1 est remplie de deux électrons et trois électrons occuperont la coquille n = 2., Parce que toute sous-coque s ne peut contenir que deux électrons, le cinquième électron doit occuper le niveau d’énergie suivant, qui sera une orbitale 2p. Il y a trois orbitales 2P dégénérées (ml = -1, 0, +1) et l’électron peut occuper n’importe laquelle de ces orbitales p. Lorsque nous dessinons des diagrammes orbitaux, nous incluons des boîtes vides pour représenter toutes les orbitales vides dans le même sous-shell que nous remplissons.

Le carbone (numéro atomique 6) a six électrons. Quatre d’entre eux remplissent les orbitales 1s et 2s. Les deux électrons restants occupent la sous-coque 2p., Nous avons maintenant le choix de remplir l’une des orbitales 2p et d’apparier les électrons ou de laisser les électrons non appariés dans deux orbitales p différentes, mais dégénérées. Les orbitales sont remplies comme décrit par la règle de Hund: la configuration de la plus basse énergie pour un atome avec des électrons dans un ensemble d’orbitales dégénérées est celle ayant le nombre maximum d’électrons non appariés. Ainsi, les deux électrons dans les orbitales de carbone 2P ont des nombres quantiques n, l et ms identiques et diffèrent par leur nombre quantique ml (en accord avec le principe D’exclusion de Pauli)., La configuration électronique et le diagramme orbital du carbone sont les suivants:

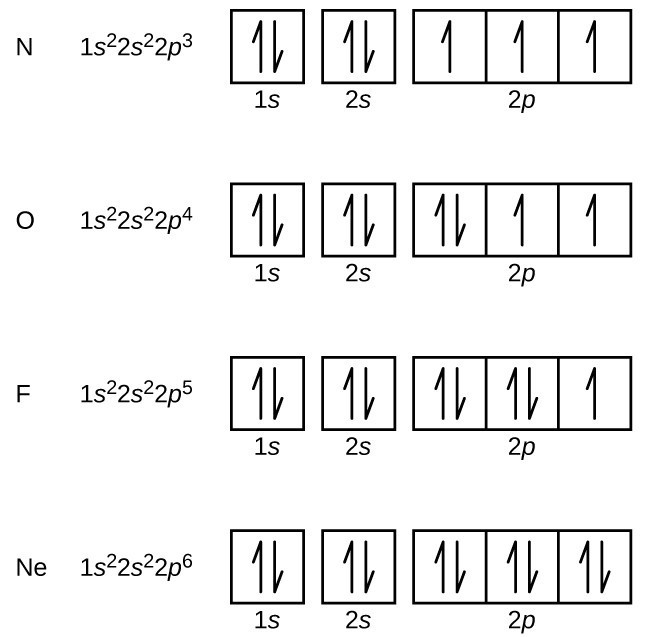
L’azote (numéro atomique 7) remplit les sous-couches 1s et 2s et possède un électron dans chacune des trois orbitales 2p, conformément à la règle de Hund. Ces trois électrons ont des spins non appariés. L’oxygène (de numéro atomique 8) a une paire d’électrons dans les orbitales 2p (les électrons ont des rotations opposées) et un seul électron dans chacun des deux autres. Le fluor (numéro atomique 9) n’a qu’une seule orbitale 2P contenant un électron non apparié., Tous les électrons du néon de gaz noble (numéro atomique 10) sont appariés et toutes les orbitales des coquilles n = 1 et n = 2 sont remplies. Les configurations d’électrons et les diagrammes orbitaux de ces quatre éléments sont:
Le métal alcalin sodium (numéro atomique 11) a un électron de plus que l’atome de néon. Cet électron doit entrer dans la sous-coque de la plus faible énergie disponible, l’orbitale 3s, donnant une configuration 1s22s22p63s1., Les électrons occupant la ou les orbitales de la coque la plus externe(valeur la plus élevée de n) sont appelés électrons de valence, et ceux occupant les orbitales de la coque interne sont appelés électrons du noyau (Figure 5). Étant donné que les coquilles d’électrons du cœur correspondent à des configurations d’électrons de gaz noble, nous pouvons abréger les configurations d’électrons en écrivant le gaz noble qui correspond à la configuration d’électrons du cœur, ainsi que les électrons de valence dans un format condensé. Pour notre exemple de sodium, le symbole représente les électrons du noyau, (1s22s22p6) et notre configuration abrégée ou condensée est 3s1.,

la Figure 5. Une configuration électronique abrégée en cœur (à droite) remplace les électrons du cœur par le symbole du gaz noble dont la configuration correspond à la configuration électronique du cœur de l’autre élément.
de même, la configuration abrégée du lithium peut être représentée par 2s1, où représente la configuration de l’atome d’hélium, qui est identique à celle de la coque interne remplie de lithium. L’écriture des configurations de cette manière souligne la similitude des configurations de lithium et de sodium., Les deux atomes, qui appartiennent à la famille des métaux alcalins, n’ont qu’un électron dans une sous-coquille de valence s en dehors d’un ensemble rempli de coquilles internes.
\begin{array}{l}\text{Li:}\left2{s}^{1}\\ \text{Na:}\left3{s}^{1}\end{array}
le métal alcalino-terreux magnésium (numéro atomique 12), avec ses 12 électrons dans une configuration 3s2, est analogue à son membre de la famille béryllium, 2s2. Les deux atomes ont une sous-coquille s remplie à l’extérieur de leurs coquilles internes remplies., L’aluminium (numéro atomique 13), avec 13 électrons et la configuration électronique 3s23p1, est analogue à son membre de la famille du bore, 2s22p1.
Les configurations électroniques du silicium (14 électrons), du phosphore (15 électrons), du soufre (16 électrons), du chlore (17 électrons) et de l’argon (18 électrons) sont analogues dans les configurations électroniques de leurs coquilles externes aux membres correspondants de la famille carbone, azote, oxygène, fluor et néon, respectivement, sauf que le nombre quantique principal de la coquille externe des éléments plus lourds a augmenté de un à n = 3., La Figure 6 montre la configuration électronique de la plus faible énergie, ou état fondamental, pour ces éléments ainsi que celle des atomes de chacun des éléments connus.

la Figure 6. Cette version du tableau périodique montre la configuration électronique de l’enveloppe extérieure de chaque élément. Notez que dans chaque groupe, la configuration est souvent similaire.
lorsque nous arrivons à l’élément suivant du tableau périodique, le métal alcalin potassium (numéro atomique 19), nous pourrions nous attendre à ce que nous commencions à ajouter des électrons à la sous-coquille 3d., Cependant, toutes les preuves chimiques et physiques disponibles indiquent que le potassium est comme le lithium et le sodium, et que l’électron suivant n’est pas ajouté au niveau 3d mais est plutôt ajouté au niveau 4s (Figure 6). Comme discuté précédemment, l’orbitale 3D sans nœuds radiaux est plus élevée en énergie car elle est moins pénétrante et plus protégée du noyau que la 4s, qui a trois nœuds radiaux. Ainsi, le potassium a une configuration électronique de 4s1. Par conséquent, le potassium correspond à Li et Na dans sa configuration de coquille de valence., L’électron suivant est ajouté pour compléter la sous-coque 4s et le calcium a une configuration électronique de 4s2. Cela donne au calcium une configuration électronique de l’enveloppe extérieure correspondant à celle du béryllium et du magnésium.
en commençant par le scandium du métal de transition (numéro atomique 21), des électrons supplémentaires sont ajoutés successivement à la sous-coque 3d. Cette sous-coque est remplie à sa capacité avec 10 électrons (rappelez-vous que pour l = 2 , Il y a 2L + 1 = 5 valeurs de ml, ce qui signifie qu’il y a cinq orbitales d qui ont une capacité combinée de 10 électrons). Le sous-shell 4p se remplit ensuite., Notez que pour trois séries d’éléments, le scandium (Sc) à travers le cuivre (Cu), l’yttrium (Y) à travers l’argent (Ag) et le lutétium (Lu) à travers l’Or (Au), un total de 10 électrons d sont successivement ajoutés à la coquille (n – 1) à côté de la coquille n pour amener cette coquille (n – 1) de 8 à 18 électrons. Pour deux séries, le lanthane (La) à travers le lutétium (Lu) et l’actinium (Ac) à travers le lawrencium (Lr), 14 électrons f (valeurs l = 3, 2L + 1 = 7 ml; ainsi, sept orbitales avec une capacité combinée de 14 électrons) sont successivement ajoutées à la coquille (n – 2) pour amener cette coquille de 18 électrons à un total de 32 électrons.,
exemple 1: nombres quantiques et Configurations D’électrons
Quelle est la configuration électronique et le diagramme orbital pour un atome de phosphore? Quels sont les quatre nombres quantiques pour le dernier électron ajoutée?
Afficher la SolutionVérifiez Votre Apprentissage
Identifier les atomes de l’électron configurations de donnée:
- 4s23d5
- 5s24d105p6.
Afficher la SolutionLe tableau périodique peut être un outil puissant dans la prédiction de la configuration électronique d’un élément. Cependant, nous trouvons des exceptions à l’ordre de remplissage des orbitales qui sont illustrées dans la Figure 3 ou la Figure 4., Par exemple, les configurations électroniques (illustrées à la Figure 6) des métaux de transition chrome (Cr; Numéro atomique 24) et cuivre (Cu; numéro atomique 29), entre autres, ne sont pas celles auxquelles nous nous attendions. En général, de telles exceptions impliquent des sous-coquilles avec une énergie très similaire, et de petits effets peuvent entraîner des changements dans l’ordre de remplissage.
dans le cas de Cr et Cu, nous constatons que les sous-coquilles à moitié remplies et complètement remplies représentent apparemment des conditions de stabilité préférentielles., Cette stabilité est telle qu’un électron passe de la 4s à l’orbitale 3d pour gagner la stabilité supplémentaire d’une sous-coque 3d à moitié remplie (en Cr) ou d’une sous-coque 3d remplie (en Cu). D’autres exceptions se produisent également. Par exemple, le niobium (Nb, numéro atomique 41) devrait avoir la configuration électronique 5s24d3. Expérimentalement, nous observons que sa configuration électronique à l’état fondamental est en fait 5s14d4., Nous pouvons rationaliser cette observation en disant que les répulsions électron-électron subies par l’appariement des électrons dans l’orbitale 5s sont plus grandes que l’écart d’énergie entre les orbitales 5s et 4D. Il n’existe pas de méthode simple pour prédire les exceptions pour les atomes où l’amplitude des répulsions entre électrons est supérieure aux petites différences d’énergie entre les sous-cellules.,
Configurations D’électrons et tableau périodique
comme décrit précédemment, le tableau périodique organise les atomes en fonction d’un nombre atomique croissant de sorte que des éléments ayant les mêmes propriétés chimiques se reproduisent périodiquement. Lorsque leurs configurations d’électrons sont ajoutées au tableau (Figure 6), on voit également une récurrence périodique de configurations d’électrons similaires dans les enveloppes extérieures de ces éléments. Parce qu’ils sont dans les coquilles externes d’un atome, les électrons de valence jouent le rôle le plus important dans les réactions chimiques., Les électrons externes ont la plus grande énergie des électrons dans un atome et sont plus facilement perdus ou partagés que les électrons du noyau. Les électrons de Valence sont également le facteur déterminant dans certaines propriétés physiques des éléments.
Les éléments d’un groupe (ou d’une colonne) ont le même nombre d’électrons de valence; les métaux alcalins lithium et sodium n’ont chacun qu’un électron de valence, les métaux alcalino-terreux béryllium et magnésium en ont chacun deux, et les halogènes fluor et chlore ont chacun sept électrons de valence., La similitude des propriétés chimiques entre les éléments du même groupe se produit parce qu’ils ont le même nombre d’électrons de valence. C’est la perte, le gain ou le partage des électrons de valence qui définit la façon dont les éléments réagissent.
Il est important de se rappeler que le tableau périodique a été développé sur la base du comportement chimique des éléments, bien avant toute idée de leur structure atomique était disponible. Nous pouvons maintenant comprendre pourquoi le tableau périodique a l’arrangement qu’il a la disposition place les éléments dont les atomes ont le même nombre d’électrons de valence dans le même groupe., Cette disposition est soulignée sur la Figure 6, qui montre sous forme de tableau périodique la configuration électronique de la dernière sous-coque à remplir par le principe D’Aufbau. Les sections colorées de la Figure 6 montrent les trois catégories d’éléments Classés par les orbitales en cours de remplissage: groupe principal, transition et éléments de transition interne. Ces classifications déterminent quelles orbitales sont comptées dans la coquille de valence, ou les orbitales de niveau d’énergie le plus élevé d’un atome.,
- Les éléments du groupe principal (parfois appelés éléments représentatifs) sont ceux dans lesquels le dernier électron ajouté entre dans une orbitale s ou P dans l’enveloppe la plus externe, représentée en bleu et en rouge sur la Figure 6. Cette catégorie comprend tous les éléments non métalliques, ainsi que de nombreux métaux et les éléments semi-métalliques intermédiaires. Les électrons de valence pour les éléments du groupe principal sont ceux avec le niveau n Le plus élevé. Par exemple, le gallium (Ga, numéro atomique 31) a la configuration électronique 4s23d104p1, qui contient trois électrons de valence (soulignés)., Les orbitales d complètement remplies comptent comme des électrons de noyau, pas de valence.
- éléments de Transition ou métaux de transition. Ce sont des éléments métalliques dans lesquels le dernier électron ajouté entre dans une orbitale D. Les électrons de valence (ceux ajoutés après la dernière configuration de gaz noble) dans ces éléments comprennent les électrons ns et (n – 1) D. La définition officielle IUPAC des éléments de transition spécifie ceux dont les orbitales D sont partiellement remplies. Ainsi, les éléments avec des orbitales complètement remplies (Zn, Cd, Hg, ainsi que Cu, Ag et Au sur la Figure 6) ne sont pas techniquement des éléments de transition., Cependant, le terme est fréquemment utilisé pour désigner l’ensemble du bloc d (de couleur jaune sur la Figure 6), et nous adopterons cet usage dans ce manuel.
- Les éléments de transition internes sont des éléments métalliques dans lesquels le dernier électron ajouté occupe une orbitale F. Ils sont indiqués en vert sur la Figure 6. Les coques de valence des éléments de transition internes sont constituées des sous – coques (n – 2)f, (n-1)d et ns., Il existe deux séries de transition interne:
- La série des lanthanides: lanthanide (La) à travers lutétium (Lu)
- la série des actinides: actinide (Ac) à travers lawrencium (Lr)
le lanthane et l’actinium, en raison de leurs similitudes avec les autres membres de la série, sont inclus et utilisés pour nommer la série, même s’ils sont des métaux de transition sans électrons F.
Configurations électroniques des Ions
Nous avons vu que les ions se forment lorsque les atomes gagnent ou perdent des électrons., Un cation (ion chargé positivement) se forme lorsqu’un ou plusieurs électrons sont retirés d’un atome parent. Pour les éléments du groupe principal, les électrons ajoutés en dernier sont les premiers électrons retirés. Pour les métaux de transition et les métaux de transition internes, cependant, les électrons dans l’orbitale s sont plus faciles à enlever que les électrons d ou f, et donc les électrons ns les plus élevés sont perdus, puis les électrons (n – 1)d ou (n – 2)f sont enlevés. Un anion (ion chargé négativement) se forme lorsqu’un ou plusieurs électrons sont ajoutés à un atome parent. Les électrons ajoutés remplissent l’ordre prédit par le principe D’Aufbau.,
Exemple 2: Prédiction de l’Électron Configurations des Ions
Quelle est la configuration électronique et de l’orbite diagramme de:
- Na+
- P3–
- Al2+
- Fe2+
- Sm3+
Afficher la SolutionVérifiez Votre Apprentissage
Qui d’ions avec un +2 taxe a pour configuration électronique 1s22s22p63s23p63d104s24p64d5? Quel ion avec une charge + 3 a cette configuration?
Show SolutionConcepts clés et résumé
L’énergie relative des sous-cellules détermine l’ordre dans lequel les orbitales atomiques sont remplies (1s, 2s, 2p, 3s, 3P, 4s, 3D, 4P, et ainsi de suite)., Les configurations d’électrons et les diagrammes orbitaux peuvent être déterminés en appliquant le principe D’exclusion de Pauli (pas deux électrons ne peuvent avoir le même ensemble de quatre nombres quantiques) et la règle de Hund (chaque fois que possible, les électrons conservent des spins non appariés dans des orbitales dégénérées).
Les électrons dans les orbitales les plus externes, appelés électrons de valence, sont responsables de la plupart du comportement chimique des éléments. Dans le tableau périodique, les éléments ayant des configurations d’électrons de valence analogues se trouvent généralement dans le même groupe., Il y a quelques exceptions à l’ordre de remplissage prévu, en particulier lorsque des orbitales à moitié remplies ou complètement remplies peuvent être formées. Le tableau périodique peut être divisé en trois catégories en fonction de l’orbitale dans laquelle le dernier électron à ajouter est placé: les éléments du groupe principal (orbitales s et p), les éléments de transition (orbitales d) et les éléments de transition internes (orbitales f).
essayez-le
- lisez les étiquettes de plusieurs produits commerciaux et identifiez les ions monatomiques d’au moins quatre éléments de transition contenus dans les produits., Écrivez les configurations électroniques complètes de ces cations.
- lire les étiquettes de plusieurs produits commerciaux et identifier les ions monatomiques d’au moins six éléments de groupe principaux contenus dans les produits. Écrivez les configurations électroniques complètes de ces cations et anions.,
- Aide complète shell interne est exécuté notation (pas d’abréviations, 1s22s22p6, et ainsi de suite), de prédire la configuration électronique de chacun des atomes suivants:
- C
- P
- V
- Sb
- Sm
- Aide complète shell interne est exécuté notation (1s22s22p6, et ainsi de suite), de prédire la configuration électronique de chacun des atomes suivants:
- N
- Si
- Fe
- Te
- Tb
- Est 1s22s22p6 le symbole d’une propriété macroscopique ou microscopique de la propriété d’un élément? Expliquez votre réponse.,
- De quelles informations supplémentaires avons-nous besoin pour répondre à la question « Quel ion a la configuration électronique 1s22s22p63s23p6”?,
- Dessiner le diagramme des orbitales de valence shell de chacun des atomes suivants:
- C
- P
- V
- Sb
- Ru
- Utiliser un diagramme des orbitales pour décrire la configuration électronique de valence shell de chacun des atomes suivants:
- N
- Si
- Fe
- Te
- Mo
- Aide complète shell interne est exécuté notation (1s22s22p6, et ainsi de suite), de prédire l’électron configurations des ions suivants.,
- N3–
- Ca2+
- S
- Cs2+
- Cr2+
- Gd3+
- quel atome a la configuration électronique 1s22s22p63s23p64s23d104p65s24d2?
- quel atome a la configuration électronique 1s22s22p63s23p63d74s2?
- quel ion avec une charge + 1 a la configuration électronique 1s22s22p63s23p63d104s24p6? Quel ion avec une charge -2 a cette configuration?
- lequel des atomes suivants ne contient que trois électrons de valence: Li, B, N, F, Ne?
- lequel des éléments suivants a deux électrons non appariés?,
- Mg
- Si
- S
- les Deux Mg et S
- les Deux Si et S.
- quel atome pourrait s’attendre à une demi-rempli 6p shell interne est exécuté?
- quel atome devrait avoir un sous-shell 4S à moitié rempli?
- dans une région D’Australie, le bétail n’a pas prospéré malgré la présence de fourrage approprié. Une enquête a montré que la cause en était l’absence de cobalt suffisant dans le sol. Le Cobalt forme des cations dans deux états d’oxydation, Co2+et Co3+. Écrivez la structure électronique des deux cations.,
- le Thallium a été utilisé comme poison dans L’histoire mystérieuse D’Agatha Christie » Le cheval pâle. »Le Thallium a deux formes cationiques possibles, +1 et +3. Les composés +1 sont les plus stables. Écrivez la structure électronique du cation +1 du thallium.
- Écrire l’électron configurations pour la suite des atomes ou des ions:
- B3+
- O
- Cl3+
- Ca2+
- Ti
- le Cobalt–60 et l’iode 131 sont des isotopes radioactifs couramment utilisés en médecine nucléaire. Combien y a-t-il de protons, de neutrons et d’électrons dans les atomes de ces isotopes?, Write the complete electron configuration for each isotope.
- Write a set of quantum numbers for each of the electrons with an n of 3 in a Sc atom.
Show Selected Solutions





