Introduction
la cuticule végétale est la couche la plus externe des plantes, qui recouvre les feuilles, les fruits, les fleurs et les tiges non ligneuses des plantes supérieures. Il protège les plantes contre la sécheresse, les températures extrêmes, les rayons UV, les attaques chimiques, les blessures mécaniques et les infections pathogènes/nuisibles. Il fournit également un soutien mécanique et sert de barrière contre la fusion d’organes (Yeats et Rose, 2013; Kim et al., 2017).,
la cuticule végétale comprend principalement une matrice de cutine (un polyester insoluble) et de cire incrustée (lipides solubles) (Figure 1) (Kunst et Samuels, 2009). Les compositions de cire et de cutine de la cuticule végétale peuvent varier considérablement selon les espèces végétales et divers organes (Yeats et Rose, 2013). La cuticule de chaque organe a des caractéristiques spécifiques, par exemple, la cuticule du fruit est généralement plus épaisse que la cuticule de la feuille et manque de stomates. Parce que la cuticule des fruits est un modulateur critique de la qualité des fruits post-récolte, comme ses effets sur la rétention d’eau des fruits (Kosma et al.,, 2010), réponses aux stress physiques et biologiques (Kosma et al., 2009), et de la fermeté (Matas et coll., 2009; Lara et coll., 2014; Vallarino et coll., 2017), il attire de plus en plus l’attention de la recherche.
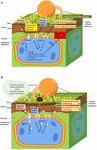
la FIGURE 1. Modèle hypothétique représentant l’implication de la cuticule de la plante lors des interactions de la plante avec divers agents pathogènes. (Un). Au cours de l’infection pathogène de plantes résistantes, les propriétés spécifiques de la cuticule peuvent affecter le résultat de l’interaction., Par exemple, en réponse à une infection, les plantes avec une cuticule plus perméable pourraient libérer des signaux de défense beaucoup plus rapidement. Ces signaux comprennent certains monomères de cutine ou composants de cire (par exemple, DAMPs), provoqués par des enzymes dégradant la cuticule ou/et la paroi cellulaire sécrétées par les agents pathogènes. Les plantes avec une cuticule plus perméable pourraient également répondre plus rapidement aux éliciteurs de l’agent pathogène (par exemple, MAMPs/PAMPs) et aux effecteurs en activant la résistance aux maladies des plantes par le biais de PTI et ETI, respectivement., La PTI et L’ETI activent toutes deux la résistance aux maladies des plantes, mais L’ETI est une réponse plus forte et plus efficace grâce aux interactions des protéines R avec les effecteurs des agents pathogènes. La réponse ETI pourrait inclure le remodelage de la cuticule et de la paroi cellulaire, la libération de composés antimicrobiens et de ROS, et la production d’hormones de défense, de protéines PR et de molécules de signalisation SAR. (B)., Au cours d’une infection par un agent pathogène sur des plantes hôtes sensibles, l’amélioration de propriétés spécifiques de la cuticule, telles que la perméabilité, pourrait entraîner une réduction des niveaux de certains monomères de cutine et/ou composants de cire qui pourraient réprimer la virulence et la pathogénicité des agents pathogènes et de leurs effecteurs. Ces monomères de cutine spécifiques et/ou composants de cire pourraient servir de signaux pour activer la défense des plantes localement et / ou systémiquement. La perméabilité accrue des cuticules pourrait également perturber les éliciteurs (MAMPs/PAMPs) qui pourraient être détectés par les récepteurs des plantes pour déclencher la défense., La libération accrue d’eau et de composés nutritifs dissous à la surface des feuilles pourrait améliorer la forme physique des agents pathogènes et soutenir leur croissance et leur pathogénicité, et faciliter l’entrée des agents pathogènes à travers la cuticule et/ou la paroi cellulaire de la plante et l’injection de leurs effecteurs virulents et pathogènes. Tous ces effets vont altérer la capacité des plantes à activer leurs mécanismes de défense et éventuellement entraîner leur susceptibilité aux agents pathogènes.,
pour la plupart des espèces végétales, les polymères de cutine contiennent principalement des acides gras (SAF) estérifiés et oxygénés liés en C16 et C18, de petites quantités de glycérol, de phényl-propanoïdes, etc., (Heredia, 2003). Les cires cuticulaires sont des mélanges complexes, qui consistent principalement en divers alcanes primaires et secondaires, alcools, aldéhydes, cétones et esters dérivés de SAF à très longue chaîne (C20-C34) (Raffaele et al., 2009; Malinovski et coll., 2014). Ainsi, les SAF sont les principaux précurseurs de la biosynthèse de la cutine et de la cire, qui se produisent principalement dans les chloroplastes végétaux., Les SAF résultants sont exportés vers le réticulum endoplasmique (ER), à travers la membrane plasmique et la paroi cellulaire des cellules épidermiques, et sont déposés au niveau de la membrane cuticulaire naissante, où ils forment des cutines, des cires et des subérines (polyesters complexes) (Kunst et Samuels, 2009; Yeats et Rose, 2013).
Il y a eu des progrès significatifs au cours des 20 dernières années sur l’identification et la caractérisation des gènes impliqués dans la biosynthèse de la cutine végétale et de la cire (Suh et al., 2005; Lee et Suh, 2013; Fich et coll., 2016)., En outre, les facteurs impliqués dans le transport des précurseurs des cutines et des cires, tels que les protéines de liaison à l’acyl-CoA (ACBPs) (Xia et al., 2012; Xue et coll., 2014), la protéine de transfert lipidique (LTP) (Deeken et coll., 2016), et le transporteur ABC (Luo et coll., 2007), ont été caractérisées. En outre, plusieurs facteurs de transcription, tels que AP2, MYB94, MYB96, MYB16 et NFXL2 à doigt de zinc, ont joué un rôle critique dans la régulation de la biosynthèse de la cutine et de la cire végétales (Fich et al., 2016; Lee et coll., 2016)., Il existe de plus en plus de preuves que la cuticule n’est pas simplement une couche physique qui protège les plantes; elle semble être activement impliquée dans la défense des plantes et les voies de signalisation pour la croissance et le développement (Raffaele et al., 2009; Javelle et coll., 2011; Aragon et coll., 2017). Diverses études ont montré que la cuticule des plantes pouvait fonctionner dans la première couche d’immunité déclenchée par un motif de défense des plantes et la deuxième couche, plus forte, d’immunité déclenchée par un effecteur de défense des plantes (ETI). Ainsi, il sert à activer la résistance acquise locale et systémique contre divers agents pathogènes (Figure 1) (Heredia, 2003; Xia et al.,, 2009; Aragon et coll., 2017). Les gènes végétaux et les facteurs de transcription impliqués dans la biosynthèse/signalisation des cuticules et les interactions plante-microbe associées ont été bien résumés dans plusieurs revues informatives (Chassot et Métraux, 2005; Muller et Riederer, 2005; Reina-Pinto et Yeephremov, 2009; Lee et Suh, 2013; Serrano et al., 2014; Fich et coll., 2016; Aragon et coll., 2017). Les études de la communauté microbienne végétale associée à la surface cuticulaire ont été bien revues par Aragón et al. (2017)., Ces études, bien que pertinentes, ne seront pas abordées plus avant dans le présent mini-examen en raison de la limitation de l’espace.
Cette revue résume brièvement les rôles multifonctionnels de la cuticule végétale lors des interactions plante-agent pathogène, en mettant l’accent sur: les changements dynamiques de la cuticule végétale et leur régulation; la diaphonie de la cuticule avec la paroi cellulaire et diverses voies de signalisation hormonale pour la défense des plantes; et les principaux mécanismes biochimiques, moléculaires et cellulaires qui sous-tendent, La présente revue traite également des défis et des orientations futures pour les études connexes, telles que les nouveaux gènes et mécanismes impliqués dans le transport, la régulation, l’assemblage et le dépôt de précurseurs/signaux cuticulaires, et les interactions plantes-pathogènes associées.
la cuticule végétale et la paroi cellulaire forment un Continuum à la Surface de la plante, qui est dynamique et sensible à diverses Infections pathogènes
la paroi cellulaire végétale s’étend entre la cuticule et la membrane cellulaire de l’épiderme et forme un continuum avec la cuticule (Figure 1; Nawrath et al., 2013)., Les principaux composants de la paroi cellulaire végétale sont la cellulose, l’hémicellulose, la pectine et la lignine. Ils participent au maintien de la forme cellulaire, au soutien de la croissance et du développement des plantes et à la protection des plantes contre les stress biotiques et abiotiques (Keegstra, 2010). Ces polysaccharides de paroi cellulaire peuvent être incorporés dans la matrice de cutine et ainsi déterminer l’élasticité et la rigidité de la cuticule entière (Lopez-Casado et al., 2007). La cire cuticulaire forme une barrière à la transpiration (Schonherr, 1976) et la matrice de cutine contribue à sa résistance mécanique (Kolattukudy, 1980).,
la cuticule et la paroi cellulaire jouent des rôles qui se chevauchent chez les plantes; en plus de leur rôle de barrières physiques et chimiques passives, elles agissent activement ensemble pour réguler le mouvement des molécules dans et hors des plantes. Ils jouent également un rôle critique dans le relais des signaux à l’intérieur et à l’extérieur des cellules végétales en réponse à diverses stimulations pour la croissance et le développement des plantes, et la résistance aux stress biotiques et abiotiques (Segado et al., 2016)., La paroi cellulaire et la cuticule peuvent se dilater et changer de composition au cours de divers stades de croissance et de développement des plantes et en réponse à diverses conditions environnementales (Bargel et Neinhuis, 2005; Underwood, 2012). Au cours des interactions plante-agent pathogène, les compositions de cuticule et de paroi cellulaire de la plante peuvent être affectées par des agents pathogènes, et inversement, les agents pathogènes peuvent détecter les composants de la surface de la plante et ajuster leur pathogenèse et leur virulence en conséquence., À un stade précoce de l’infection, les champignons phytopathogènes peuvent synthétiser des enzymes hydrolytiques, telles que les cutinases, les estérases et les lipases, qui ciblent directement la cuticule et jouent ainsi un rôle clé dans l’infection pathogène (Berto et al., 1999; Garrido et coll., 2012; Leroch et coll., 2013; Wang et coll., 2017). Par exemple, L’agent pathogène fongique Fusarium oxysporum sécrète des cutinases, qui dégradent la cuticule des feuilles des plantes et produisent des niveaux basaux de monomères de cutine pour faciliter l’adhésion de l’agent pathogène aux hôtes à un stade précoce de l’infection., Une fois qu’un agent pathogène détecte les monomères de cuticules végétales qui en résultent, il peut étendre son activité cutinase pour faciliter la pénétration et l’infection dans la couche de cuticules végétales (Woloshuk et Kolattukudy, 1986). Les composants de la cutine des feuilles de la plante, tels que l’hexadécanediol dans le riz, pourraient induire la germination et la différenciation appressorium du champignon blast du riz Magnaporthe grisea (Gilbert et al., 1996) et la germination des spores et l’expression de la cutinase du champignon de la moisissure grise Botrytis cinerea (Leroch et al., 2013)., De plus, les composants de la cire des feuilles des plantes, tels que les aldéhydes C26 à très longue chaîne du maïs (Zea mays), pourraient affecter la germination des spores et la pénétration de l’oïdium de l’orge Blumeria graminis f. sp. hordei (Hansjakob et coll., 2011). Fait intéressant, de nombreux champignons, tels que le Botrytis (Castillo et al. En 2017), Phytophthora (Blackman et coll., 2014), et M. oryzaea (Quoc et Chau, 2017) sécrètent également des enzymes dégradant la paroi cellulaire (CAZymes) avant même qu’elles ne pénètrent dans la cuticule, ce qui est une preuve supplémentaire que le continuum cuticule/paroi cellulaire est un facteur important dans les interactions plante-pathogène.,
à L’inverse, les plantes peuvent reconnaître l’attachement des agents pathogènes et réagir très rapidement aux éliciteurs (MAMPs / PAMPs) qu’elles produisent. Les DAMPs, les produits de dégradation des plantes générés par l’infection par l’agent pathogène, tels que les monomères de cutine et les oligosaccharides de la paroi cellulaire, servent également de signaux qui activent les défenses des plantes contre l’agent pathogène (Underwood, 2012; Malinovsky et al., 2014)., Par exemple, la cuticule des fruits de la tomate a été remodelée en réponse à l’infection des agents pathogènes fongiques Colletotrichum gloeosporioides, et la biosynthèse des cuticules des fruits a été régulée à la hausse pendant la formation de l’appressorium avant même la pénétration (Alkan et al., 2015). Un autre exemple, lors de l’infection de pétales d’agrumes par Colletotrichum acutatum, les cellules épidermiques ont répondu à l’agent pathogène en augmentant la synthèse lipidique et le dépôt de composés associés à la cuticule et à la paroi cellulaire, ce qui a finalement altéré les structures de la cuticule (Marques et al., 2016)., Chez Arabidopsis, au lieu de cuticules, les galles de la couronne causées par l’infection par la bactérie Agrobacterium tumefaciens sont recouvertes de subérine, qui a besoin du transport du SAF pour soutenir sa synthèse (Deeken et al., 2016).
en plus de la cire et de la cutine, la cuticule végétale contient des terpénoïdes et des flavonoïdes, qui ont des activités antifongiques (Arif et al., 2009; Zacchino et coll., 2017). La biosynthèse de ces phénylpropanoïdes et flavonoïdes suit la formation de lipides cuticulaires (Mintz-Oron et al., 2008), qui pourraient être induites en réponse à des signaux environnementaux, tels que C., gloeosporioides infection, activant ainsi les défenses des plantes dans la tomate et la mangue (Alkan et al., 2015; Sivankalyani et coll., 2016).
perméabilité des cuticules, Composition et rôles multiples au cours de L’Interaction plante-agent pathogène
la cuticule des plantes joue également un rôle critique dans la défense des plantes contre divers agents pathogènes bactériens et fongiques, dont la plupart utilisent des ouvertures naturelles, telles que les stomates et les hydathodes dans les feuilles, ou les lenticelles dans les fruits, 2014)., L’intégrité et la perméabilité de la cuticule sont très importantes pour sa fonction lors des interactions plante-agent pathogène; par exemple, une cuticule végétale plus perméable pourrait entraîner une résistance ou une susceptibilité aux infections pathogènes.
études antérieures sur les mutants défectueux de la cuticule de L’Arabidopsis et de la tomate, tels que le CYP86A2 (oxydases dépendantes du cytochrome P450) (Xiao et al., 2004), LACS2 (Acyl-CoA synthétases à longue chaîne) (Bessire et al., 2007; Tang et coll., 2007), PER57 (peroxydase surexprimée 57) (Survila et al., 2016), BODYGUARD (alpha-bêta hydrolase) (Céline et al.,, 2007), et DEWAX facteur de transcription (Suh et Aller, 2014; Ju et coll., 2017) ont montré une augmentation de la perméabilité des cuticules foliaires. Fait intéressant, ces mutants ont amélioré la résistance des plantes contre L’agent pathogène fongique B. cinerea, mais ont augmenté la susceptibilité à L’agent pathogène bactérien Pseudomonas syringae. Cependant, tous les mutants liés à la cuticule n’ont pas montré de résistance à B., cinerea: par exemple, notre étude précédente a révélé que les mutants Arabidopsis ACP4 (protéine porteuse d’acyle 4) et GL1 (glabre 1) avaient une diminution des niveaux de cutine et de composants de cire, une augmentation de la perméabilité de la cuticule foliaire et une sensibilité accrue aux deux agents pathogènes (Xia et al., 2009, 2010). Dans d’autres études, des mutations dans les facteurs de transcription de la brillance ont entraîné une altération de la cuticule, ce qui a conduit à la susceptibilité des plantes à l’infection par B. cinerea (Sela et al., 2013; Buxdorf et coll., 2014).
plusieurs mécanismes peuvent expliquer l’augmentation de la résistance des feuilles à B., cinerea et d’autres agents pathogènes lorsque la perméabilité des cuticules des plantes augmente:
(1) libération de certains monomères de cutine ou composants de cire qui agissent comme des signaux pour activer la résistance aux maladies des plantes (Aragón et al., 2017);
(2) libération de diffusats antifongiques et de ROS (espèces réactives de l’oxygène) qui inhibent la croissance des agents pathogènes et l’infection à la surface (L’Haridon et al., 2011; Sela et coll., 2013);
(3) Accélération de l’absorption des éliciteurs (par ex.,, MAmps/PAMPs / DAMPs) activés par des agents pathogènes pour PTI; et libération d’effecteurs avirulents pour ETI, ce qui pourrait stimuler une réponse de défense végétale plus forte et plus efficace (Chassot et al., 2008; Aragon et coll., 2017).
un modèle hypothétique du mécanisme connexe de résistance aux maladies des plantes est représenté à la Figure 1A.
plusieurs mécanismes ont été suggérés par lesquels la perméabilité des cuticules foliaires pourrait augmenter la sensibilité des Plantes au P., syringae et autres agents pathogènes:
(1) Réduction des niveaux de certains monomères de cutine et / ou composants de cire qui aident à réprimer l’expression et la fonction des effecteurs pathogènes impliqués dans la virulence et la pathogénicité, tels que Arabidopsis CYP86A2. Ce gène est impliqué dans la formation de C16 et C18 hydroxy FAs, qui ont des impacts inhibiteurs directs contre certains agents pathogènes, tels que P. syringae (Xiao et al., 2017).,
(2) réductions des niveaux de monomères de cutine et/ou de composants de cire qui peuvent servir de signaux ou de récepteurs pour activer la défense des plantes localement et/ou systémiquement pour PTI et ETI; dans notre étude précédente sur Arabidopsis ACP4, les plantes mutantes ACP4 ont considérablement réduit la biosynthèse de cutine et de cire, causant ainsi des défauts dans l’immunité locale et systémique des plantes contre P. syringae (Xia et al., 2009, 2010).,
(3) altération de la réponse de défense des plantes par perturbation de la perception par les récepteurs des plantes des éliciteurs générés par les agents pathogènes (MAMPs/PAMPs) ou activation sur-stimulée de certains gènes par la production accélérée de ROS pour provoquer la susceptibilité et la mort des plantes (Sela et al., 2013).
(4) Disponibilité accrue d’eau et de composés nutritifs dissous à la surface des feuilles, ce qui améliorerait la forme physique, la croissance et la pathogénicité des agents pathogènes (Schreiber et al.,, 2005);
(5) modifications apportées aux stomates et au continuum de la paroi cuticule-cellule qui permettent aux agents pathogènes de pénétrer plus facilement dans les plantes et de libérer leurs effecteurs de virulence à l’intérieur.
le modèle hypothétique pour expliquer le mécanisme connexe dans la susceptibilité aux maladies des plantes est illustré à la Figure 1B.
puisque B. cinerea est un agent pathogène nécrotrophique et P. syringae est un agent pathogène hémi-biotrophique, la cuticule peut avoir des modes d’action spécifiques pour interagir avec des agents pathogènes ayant des styles de vie différents., Les fonctions spécifiques de divers composants de la cuticule des feuilles des plantes peuvent jouer divers rôles dans les interactions plante-agent pathogène; cependant, cela nécessite une étude plus approfondie.
le rôle de la cuticule des fruits dans la protection post-récolte contre les agents pathogènes a été largement étudié. Des découvertes récentes suggèrent que la composition des cuticules, plutôt que leur simple épaisseur, détermine la réponse des fruits aux agents pathogènes post-récolte. Par exemple, au cours de la maturation des fruits, la sensibilité des fruits de la tomate à l’infection fongique nécrotrophe pathogène a augmenté (Segado et al.,, 2016), alors que les baies de raisin ont acquis une résistance à l’agent pathogène fongique biotrophe oïdium (Uncinula necator) au fur et à mesure de leur croissance et de leur développement (Fich et al., 2016). Ainsi, les multiples rôles de la cuticule végétale au cours des interactions plante-pathogène peuvent être affectés par l’épaisseur de la cuticule, la perméabilité ou des composants cuticulaires spécifiques dans différents tissus; ils varient également avec différents stades de croissance et conditions environnementales.,
les Hormones sont impliquées dans la Formation des cuticules et la signalisation connexe au cours des Interactions plante-agent pathogène
Les Hormones régulent la croissance des plantes tout au long du cycle de vie, contrôlant la division cellulaire, l’élongation et la différenciation, la formation et le développement des motifs tissulaires et les réponses aux stress biotiques et abiotiques (Robert-Seilaniantz et al., 2007). Des progrès significatifs ont été réalisés dans l’étude de la biosynthèse et la régulation de diverses hormones, telles que l’acide salicylique (SA), l’acide jasmonique (JA), les gibbérellines (GA), l’acide abscissique (ABA) et l’éthylène (ET) (Kimbara et coll.,, 2013; De Smet et coll., 2015). Et les rôles critiques de ces hormones dans les interactions plante-microbe ont été bien documentés (Denancé et al., 2013). L’étude de la diaphonie entre les hormones végétales et la cuticule pour sa biosynthèse et ses fonctions connexes pendant les conditions de stress, telles que l’infection par un agent pathogène, a également été étudiée, mais il reste de grandes lacunes dans nos connaissances.
Il a été démontré que plusieurs hormones végétales influencent la formation de cuticules végétales et la tolérance au stress., Par exemple, nous avons constaté que les plantes Arabidopsis traitées en GA4 et GA7 présentaient des niveaux accrus de composants de cire cuticulaire et de cutine, qui étaient associés à l’amélioration de l’immunité des plantes contre L’infection bactérienne par L’agent pathogène p. syringae (Xia et al., 2010).
l’acide jasmonique, une hormone importante dans la défense des plantes, est dérivé du FA 18:3 (acide linolénique). On a constaté que le traitement par méthyl-JA de plantules Vicia sativa induisait la production de ω-hydroxy FAs, qui étaient impliqués dans la formation de cutine (Pinot et al., 1998)., De plus, Le ω-hydroxy FAs pourrait induire une résistance des plantes contre l’infection pathogène en agissant comme molécules de signalisation endogènes; par exemple, ils pourraient jouer un rôle critique dans la résistance de l’orge contre L’agent pathogène fongique Erysiphe graminis f. sp. hordei (Schweizer et coll., 1996).
le gène Arabidopsis RST1 (RESURRECTION1) fonctionne de manière importante à la fois dans la biosynthèse de la cutine et de la cire, et dans la défense des plantes. Les plantes mutantes rst1 ont montré une résistance à B. cinerea qui était associée aux niveaux d’expression up-régulés de JA et au gène de défense connexe PDF1.2., Cependant, les plantes mutantes rst1 présentaient des niveaux régulés à la baisse de protéines SA et PR, telles que PR-1, qui étaient corrélées à leur sensibilité à L’agent pathogène biotrophique, Erysiphe cichoracearum (Mang et al., 2009).
Les plantes mutantes du facteur de transcription SHN1 D’Arabidopsis présentaient des compositions de cuticules foliaires défectueuses et une sensibilité accrue à B. cinerea. Les plantes shn1-1D ont accumulé des niveaux élevés de H2O2 et ont régulé un grand nombre de gènes associés à la sénescence, au stress oxydatif et à la défense (Sela et al., 2013)., Par exemple, les gènes associés au ROS PROPEP3 (précurseur du peptide elicitor 3) et AOX1d (gène alternatif de l’oxydase) étaient fortement régulés. On avait prédit que PROPEP3 serait l’Amplificateur des voies ET/JA et SA, et l’expression D’AOX1d était également associée à ces voies (Lin et Wu, 2004; Huffaker et Ryan, 2007). La susceptibilité de B. cinerea des plantes shn1-1D pourrait être excessivement accélérée la génération de ROSs, comme H2O2, conduisant à des réactions de défense incontrôlées et excessives, et par conséquent la sensibilité et la mort des plantes (Sela et al., 2013).,
en outre, l’application exogène D’ABA peut spécifiquement stimuler la formation de composants cuticulaires chez les plants D’Arabidopsis, de Lepidium sativum et de tomate, ce qui a contribué à réduire la perte d’eau des plantes pendant la sécheresse (Kosma et al., 2009; Macková et coll., 2013; Cui et coll., 2016; Martin et coll., 2017). De plus, un mutant sitiens (sit) déficient en ABA de la tomate avec des taux d’ABA réduits et une perméabilité accrue des cuticules a montré une résistance accrue contre B. cinerea., La résistance à la maladie associée était associée non seulement à des modifications de la perméabilité des cuticules, mais également à des modifications de la composition de la paroi cellulaire. Par exemple, après l’infection par l’agent pathogène, les niveaux de méthyl-estérification de la pectine et de divers oligosaccharides étaient plus élevés chez les mutants que chez les plantes de type sauvage (Curvers et al., 2010).
Les mécanismes de diaphonie entre les voies de la cuticule et des hormones végétales lors des interactions des agents pathogènes avec les fruits n’ont commencé à être élucidés que récemment., En effet, la signalisation ABA et ET jouent un rôle important dans la régulation de la biosynthèse et de la fonction des cuticules des fruits (Alkan et Fortes, 2015; Leida et al., 2016; Wang et coll., 2017).
les possibilités de diaphonie d’autres voies hormonales avec la biosynthèse des cuticules et les voies de signalisation sont largement inconnues. Les interactions entre les hormones végétales et la cuticule végétale en relation avec la réponse aux infections pathogènes doivent être davantage étudiées.,
Conclusion et Perspectives
dans l’ensemble, nous avons brièvement résumé les progrès récents dans notre connaissance des rôles multiples de la cuticule végétale lors des interactions avec divers agents pathogènes. Des recherches dans des domaines connexes ont montré que la cuticule des plantes joue un rôle critique lors des interactions plante-agent pathogène. Cependant, nous sommes encore loin de comprendre pleinement les mécanismes pertinents et de développer des stratégies efficaces pour utiliser la cuticule végétale pour la défense des plantes., En outre, des études sur plusieurs aspects renforceront notre compréhension des mécanismes connexes, notamment les rôles spécifiques des différents composants de la cutine et de la cire en tant que facteurs importants et molécules de signalisation qui favorisent la résistance ou la susceptibilité; la transmission et la perception des facteurs et signaux connexes; et la diaphonie entre la paroi cuticulaire et les voies de, Les études de tout cela nous fourniront des connaissances plus détaillées pour développer des approches de sélection et biotechnologiques pour améliorer la fonction des cuticules et améliorer ainsi la santé et le rendement des plantes.
contributions des auteurs
YX et CZ ont organisé et écrit l’ensemble du manuscrit, ZZ et YG ont contribué à une partie de l’écriture et de l’amélioration.,
Financement
Ce projet a été soutenu par le projet Hatch de L’USDA-Nifa-OHO01392; L’Ohio Agricultural Research and Development Center (Oardc) seed grant OHOA1591& OHOA1615; Fonds de démarrage de L’OARDC et de L’Ohio State University à YX.
déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous tenons à remercier Yonatan Ziv pour son aide avec les chiffres.,
Schonherr, J. (1976). Perméabilité à l’eau des membranes cuticulaires isolées: l’effet du pH et des cations sur la diffusion, la perméabilité hydrodynamique et la taille des pores polaires dans la matrice de cutine. Planta 128, 113-126. doi: 10.1007/bf00390312
PubMed Abstract | CrossRef Texte Intégral | Google Scholar