A Microbial Biorealm page on the genus Pseudomonas aeruginosa
Classification
Higher order taxa
Bacteria
Proteobacteria
Gamma proteobacteria
Pseudomonadales
Pseudomonadaceae
Pseudomonas
Pseudomonas aeruginosa group
Species
NCBI: Taxonomy
Pseudomonas aeruginosa

Description et signification
Pseudomonas aeruginosa est une bactérie gram-négative, en forme de bâtonnet, asporogène et monoflagellée qui a une incroyable polyvalence nutritionnelle. C’est une tige d’environ 1-5 µm de long et de 0,5 à 1,0 µm de large. P. aeruginosa est un respirateur obligatoire, utilisant la respiration aérobie (avec de l’oxygène) comme métabolisme optimal bien qu’il puisse également respirer anaérobiquement sur le nitrate ou d’autres accepteurs d’électrons alternatifs. P., aeruginosa peut cataboliser un large éventail de molécules organiques, y compris des composés organiques tels que le benzoate. Cela fait donc de P. aeruginosa un microorganisme très omniprésent, car il a été trouvé dans des environnements tels que le sol, l’eau, les humains, les animaux, les plantes, les eaux usées et les hôpitaux (1). Dans tous les écosystèmes aquatiques oligotropes, qui contiennent une teneur élevée en oxygène dissous mais de faibles nutriments végétaux, P. aeruginosa est l’habitant prédominant, ce qui en fait clairement l’organisme le plus abondant sur Terre (2).
P. aeruginosa est un pathogène humain opportuniste., Il est” opportuniste » car il infecte rarement les individus en bonne santé. Au lieu de cela, il colonise souvent les patients immunodéprimés, comme ceux atteints de fibrose kystique, de cancer ou du SIDA (3). C’est un agent pathogène si puissant que, premièrement, il attaque les deux tiers des patients hospitalisés gravement malades, ce qui laisse généralement présager des maladies plus invasives. Deuxièmement, P. aeruginosa est l’un des principaux pathogènes opportunistes à Gram négatif dans la plupart des centres médicaux, avec un taux de mortalité de 40 à 60%., Troisièmement, il complique 90% des décès dus à la fibrose kystique; et enfin, il est toujours répertorié comme l’un des trois agents pathogènes à Gram négatif les plus fréquents et est lié aux pires maladies visuelles (4). De plus, P. aeruginosa est une bactérie du sol très importante qui est capable de décomposer les hydrocarbures aromatiques polycycliques et de fabriquer des rhamnolipides, des quinolones, du cyanure d’hydrogène, des phénazines et des lectines (5). Il présente également une résistance intrinsèque à de nombreux types d’agents chimiothérapeutiques et d’antibiotiques, ce qui en fait un agent pathogène très difficile à éliminer (1).,
P. aeruginosa a été décrite pour la première fois comme une espèce bactérienne distincte à la fin du XIXe siècle, après le développement de milieux de culture stériles par Pasteur. En 1882, la première étude scientifique sur P. aeruginosa, intitulée « Sur la coloration bleue et verte des bandages”, a été publiée par un pharmacien nommé Carle Gessard. Cette étude a montré la pigmentation caractéristique de P. aeruginosa: P., aeruginosa a produit des pigments solubles dans l’eau qui, lors de l’exposition à la lumière ultraviolette, fluorescent lumière bleu-vert. Cela a ensuite été attribué à la pyocyanine, un dérivé de la phénazine, et cela reflétait également les anciens noms de l’organisme: kind of bacillus pyocyaneus, Bakterium aeruginosa, Pseudomonas polycolor et Pseudomonas pyocyaneus (3). P. aeruginosa a de nombreuses souches, y compris Pseudomonas aeruginosa souche PA01, Pseudomonas aeruginosa PA7, Pseudomonas aeruginosa souche UCBPP-PA14, et Pseudomonas aeruginosa souche 2192 (5)., La plupart d’entre eux ont été isolés en fonction de leur odeur distinctive d’aminoacétophénone, de la production de pyocyanine et de la structure des colonies sur gélose (6).
structure du génome
P. aeruginosa a la taille du génome d’environ 5,2 à 7 millions de paires de bases (Mbp) avec une teneur en Guanine + Cytosine de 65%. Il s’agit d’une combinaison de segments accessoires variables et d’un noyau conservé. Le génome accessoire variable est caractérisé par un ensemble d’îles et d’îlots génomiques d’un type insulaire primitif intégré à l’ARNt. Le génome central se compose d’un faible niveau de divergence nucléotidique de 0.,5% et une synténie de gènes, ce qui signifie que deux ou plusieurs gènes, qu’ils soient liés ou non, sont sur le même chromosome (7).

P. aeruginosa possède un chromosome circulaire unique et sur-enroulé dans le cytoplasme (4). Il porte également beaucoup de plasmides mobilisant les chromosomes qui sont très importants pour le mode de vie de l’organisme en tant qu’agent pathogène., Les plasmides, TEM, OXA et PSE, par exemple, sont codés pour la production de bétalactamase, qui est nécessaire à sa résistance aux antibiotiques, permettant ainsi à P. aeruginosa d’être un agent pathogène redoutable (8).,
Les deux souches qui ont la séquence complète du génome sont Pseudomonas aeruginosa PA01 et Pseudomonas aeruginosa PA14 (9):
–en 2000, un groupe de « scientifiques de Pseudomonas » volontaires, y compris ceux du Washington PathoGenesis Corportaion et du Département de biologie de L’Université de Californie à San Diego, a travaillé dans le cadre du Pseudomonas aeruginosa Community Annotation Project (PseudoCAP) pour publier PA01., Cela a été fait parce que connaître la séquence génomique fournirait de nouvelles informations sur cette bactérie en tant qu’agent pathogène et sur sa polyvalence Écologique et sa complexité génétique. Avec 6 264 403 paires de bases, son génome bactérien est le plus grand jamais séquencé. Il contient également 5 570 cadres de lecture ouverts prédits (ORF), et donc il a presque la complexité génétique des eucaryotes simples, tels que Saccharomyces cerevisiae. À l’aide D’un échantillonnage au fusil de chasse du génome entier, le génome complet de 6,3 Mbp de Pseudomonas aeruginosa PA01 est très similaire au P., la carte physique d’aeruginosa, avec une seule exception majeure, qui est l’inversion d’environ un quart du génome de Pseudomonas aeruginosa PA01. Cette inversion provient de la recombinaison homologue des loci rrnA et rrnB, et des études antérieures sur les inversions de séquence génomique des loci d’ADN ribosomique chez S. typhimurium et E. coli suggèrent que cette inversion pourrait avoir une signification adaptative (10).
currently la séquence complète du génome de Pseudomonas aeruginosa PA14 est actuellement réalisée par des scientifiques de la Harvard Medical School., L’objectif de cette étude est d’obtenir des données publiques sur le génome de Pseudomonas aeruginosa PA14. La phase de séquençage au fusil de chasse du projet s’est achevée en 2005, produisant 6,54 Mbp de séquence PA14. Il est actuellement comparé au génome de Pseudomonas aeruginosa PA01 et les résultats préliminaires ont montré qu’ils sont très similaires mais présentent plusieurs régions de différences marquées, comme l’insertion du 107911BP dans le PA14, qui est absent dans le PA01. Approximativement, il y a 96,3% de la séquence D’ADN de PAO1 est dans PA14, et 92,4% de la séquence D’ADN de PA14 est dans PA01 (11).,
structure cellulaire et métabolisme
protéine F Since P. aeruginosa étant un microbe Gram négatif, sa membrane externe contient la protéine F (OprF). OprF fonctionne comme une porine, permettant à certaines molécules et ions d’entrer dans les cellules, et comme une protéine structurelle, en maintenant la forme de la cellule bactérienne. Étant donné que L’OprF fournit à la membrane externe de P. aeruginosa une limite D’exclusion de 500 Da, il abaisse la perméabilité de la membrane externe, une propriété souhaitée car elle diminuerait L’apport de substances nocives dans la cellule et donnerait du P., aeruginosa une haute résistance aux antibiotiques (12).
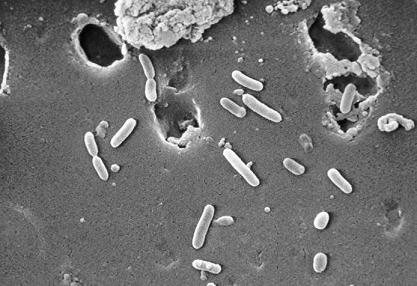
flagelle et Pili–P. aeruginosa utilise son flagelle unique et polaire pour se déplacer et afficher la chimiotaxie vers des molécules utiles, comme les sucres. Ses souches ont des flagelles de type a ou de type b, une classification basée principalement sur la taille et l’antigénicité de la sous-unité flagelline. Le flagelle est très important pendant les premiers stades de l’infection, car il peut s’attacher aux tissus des hôtes et les envahir (13). De même que son flagelle, P., aeruginosa pili contribue grandement à sa capacité à adhérer aux surfaces muqueuses et aux cellules épithéliales. Plus précisément, c’est la pointe du pili qui est responsable de l’adhérence à la surface de la cellule hôte. P. aeruginosa ont N-méthyl-phényl-alanine (NMePhe) ou pili de type IV (1). Les pili sont caractérisés comme de longs filaments polaires constitués d’homopolymères issus de la protéine piline, codée par le gène pilA (4). Dans L’Ensemble, P., aeruginosa flagellum et pili ont des fonctionnalités et une structure similaires (pour la fixation) (les deux sont des structures filamenteuses à la surface de la cellule), et leur motilité est contrôlée par RpoN, en particulier lors de la fixation initiale à l’hôte humain et dans des conditions de faible teneur en nutriments (1).
lors de L’infection de son hôte, P., aeruginosa est affamé de fer parce que la privation de fer d’un agent pathogène infectant est la partie clé du mécanisme de défense innée des humains. Pour surmonter ce défi, P. aeruginosa synthétise deux sidérophores: pyochelin et pyoverdin. P. aeruginosa cache ensuite ces latérophores à l’extérieur de la cellule, où ils se lient étroitement au fer et ramènent le fer dans la cellule. De plus, P. aeruginosa peut également utiliser du fer provenant de l’entérobactine, un sidérophore spécial produit par E. coli pour le transport du fer, afin de satisfaire ses besoins en fer (14).
P., aeruginosa est un aérobe facultatif; son métabolisme préféré est la respiration. Il gagne de l’énergie en transférant des électrons du glucose, un substrat réduit, à l’oxygène, l’accepteur final d’électrons (15). La dégradation du glucose nécessite qu’il s’oxyde en gluconate dans le périplasme, puis il sera amené à l’intérieur de la membrane interne par un système spécifique d’absorption de gluconate dépendant de l’énergie. Une fois à l’intérieur, le gluconate est phosphorylé en 6-P-gluconate, qui entrera dans le métabolisme central pour produire de l’énergie pour la cellule (16). Cependant, lorsque P. aeruginosa est en conditions anaérobies, P., aeruginosa utilise le nitrate comme accepteur terminal d’électrons(17). Dans des conditions de stress oxydatif, P. aeruginosa synthétise des enzymes de superoxyde dismutase (SOD) contenant du Fe ou du Mn, qui catalysent L’O – Très réactif en H2O2 et O2. Il détoxifie également H2O2 en O2 et H2O en utilisant la catalase (1).
écologie
puisque P. aeruginosa peut vivre dans des environnements inanimés et humains, il a été caractérisé comme un micro-organisme « ubiquitaire”. Cette polyvalence est rendue possible par un grand nombre d’enzymes qui permettent à P. aeruginosa d’utiliser une diversité de substances comme nutriments., Le plus impressionnant, P. aeruginosa peut passer de la culture sur des environnements non-mucoïdes à des environnements mucoïdes, ce qui vient avec une grande synthèse d’alginate. Dans un environnement inanimé, P. aeruginosa est généralement détecté dans des réservoirs d’eau pollués par les animaux et les humains, tels que les eaux usées et les puits à l’intérieur et à l’extérieur des hôpitaux. On le trouve également dans les piscines et les Bains à remous car les températures chaudes sont favorables à sa croissance (3)., Comme il a prospéré dans des conditions chaudes, cependant, il a été déterminé qu’il était le coupable de l’éruption du bain à remous, dans laquelle le contact direct entre la peau et l’eau infectée du bain rendra la peau infectée irritante et lui donnera une couleur rouge bosselée (19). En outre, P. aeruginosa est un pathogène humain opportuniste qui provoque des infections chroniques chez les patients atteints de fibrose kystique et est la principale cause de décès par des bactéries à Gram négatif (plus sous pathologie) (3).
bien que la plupart des interactions P. aeruginosa-plante soient préjudiciables à la plante, une étude récente a trouvé un P., souche aeruginosa qui soutient réellement la croissance des plantes. Cette caractéristique, associée au fait que P. aeruginosa peut dégrader les hydrocarbures aromatiques polycycliques, suggère les utilisations futures de P. aeruginosa pour la détoxification environnementale des produits chimiques synthétiques et des pesticides et à des fins industrielles (3). Psuedomonas aeruginosa est unique en raison de sa capacité à infecter à la fois les humains et les plantes, l’un des rares organismes pouvant infecter les deux règnes.
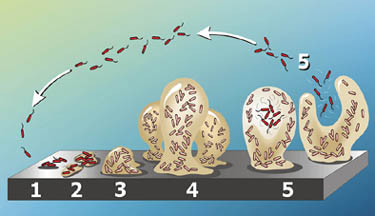
Les groupes de P. aeruginosa ont tendance à former des biofilms, qui sont des communautés bactériennes complexes qui adhèrent à une variété de surfaces, y compris les métaux, les plastiques, les matériaux d’implant médical et les tissus. Les Biofilms sont caractérisés par” attachés pour la survie » car une fois formés, ils sont très difficiles à détruire. Selon leur emplacement, les biofilms peuvent être bénéfiques ou nuisibles à l’environnement., Par exemple, les biofilms trouvés sur les roches et les cailloux sous l’eau des lacs et des étangs sont une source de nourriture importante pour de nombreux organismes aquatiques. Au contraire, celles qui se sont développées à l’intérieur des conduites d’eau pourraient provoquer des colmatements et des corrosions (19) (20).
Pathologie

P. aeruginosa provoque rarement des maladies chez des humains en bonne santé., Il est généralement lié aux patients dont le système immunitaire est compromis par des maladies ou des traumatismes. Il gagne l’accès aux tissus de ces patients par les brûlures, pour les victimes de brûlures, ou par une maladie sous-jacente, comme la fibrose kystique. Tout d’abord, P. aeruginosa adhère aux surfaces tissulaires en utilisant son flagelle, son pili et son exo-S; ensuite, il se réplique pour créer une masse critique infectieuse; et enfin, il endommage les tissus en utilisant ses facteurs de virulence (21). Étant donné que les puissantes exotoxines et endotoxines libérées par P. aeruginosa au cours des bactériémies continuent D’infecter l’hôte même après P., aeruginosa a été tué par des antibiotiques, les maladies aiguës causées par P. aeruginosa ont tendance à être chroniques et potentiellement mortelles. De plus, à l’exception de la souche de la fibrose kystique, la plupart des souches de P. aeruginosa qui attaquent les patients compromis ont tendance à être non mucoïdes (2). Et même si une petite quantité de patients infectés par P. aeruginosa ont développé une septicémie sévère avec des lésions à Centres noirs, la plupart des patients n’ont présenté aucun effet pathologique évident de la colonisation (22).
la fibrose kystique (FK) est le trouble autosomique récessif le plus courant chez les Caucasiens., Avec une mutation sur le chromosome 7, un poumon CF ne peut pas transporter le chlorure (Cl -), le sodium (Na+) et l’eau du basolatéral à l’épithélium sécrétoire. Cette perturbation de l’équilibre du sel et de l’eau dans la cellule entraîne la production d’un mucus épais, qui devient le foyer idéal pour les agents pathogènes potentiels. P. aeruginosa attaque les patients atteints de mucoviscidose par voie aérienne et une fois dedans, il utilise son flagelle pour se rendre dans la zone hypoxique, un environnement appauvri en oxygène. À cet endroit, P. aeruginosa subit une transition d’un microbe aérobie à un microbe anaérobie et commence à former des biofilms anaérobiquement., Une fois celle-ci formée, Les P. aeruginosa de cette communauté peuvent détecter leur population via la détection du quorum, où ils sécrètent des phéromones de faible poids moléculaire qui leur permettent de communiquer entre eux (23). Cela leur donne la capacité de résister à de nombreuses défenses, y compris les antibiotiques anti-Pseudomonas tels que la ticarcilline, la ceftazidime, la tobramycine et la ciprofloxacine, car une fois que les bactéries sentent que leur couche externe de biofilm est détruite, les couches internes se renforceront pour rétablir la communauté (24). P., aeruginosa est également résistant à de nombreux antibiotiques et agents chimiothérapeutiques en raison de leur résistance intrinsèque. Ceci est causé par la faible perméabilité aux antibiotiques de la membrane externe et par la production de β-lactamases contre les pompes d’efflux multidrogue et les antibiotiques β-lactamines (22).
P. aeruginosa communique avec d’autres cellules grâce à la détection du quorum. Cette forme de communication permet aux cellules de réguler la production de gènes, ce qui entraîne le contrôle de certaines fonctions cellulaires. L’une des enzymes responsables de la détection du quorum est la tyrosine phosphatase (TpbA)., Cette enzyme relaie des signaux de détection du quorum extracellulaire à la production de polysaccharides et à la formation de biofilm à l’extérieur des cellules (32). P. aeruginosa se fixe aux surfaces par la production de biofilm. La détection du Quorum peut être une cible médicamenteuse pour guérir les infections causées par P. aeruginosa. La trempe du Quorum est utilisée pour bloquer le mécanisme de signalisation de la détection du quorum et empêcher la formation de biofilm chez P. aeruginosa. Yi-Hu Dong et ses collègues ont pu empêcher la formation de biofilm chez la souris dans des conditions de laboratoire (33).
P. aeruginosa cache de nombreux facteurs virulents pour coloniser les cellules de son hôte., Par exemple, l’exotoxine A, la protéine la plus toxique produite par P. aeruginosa, catalyse L’ADP-ribosylation pour former L’ADP-ribosyl-EF-2, qui inhibe la synthèse protéique des cellules de l’hôte. De plus, l’élastase, une protéase de zinc extracellulaire, attaque les protéines eucaryotes telles que le collagène et l’élastine et détruit les protéines structurelles de la cellule. Il décompose également l’immunoglobine humaine et les protéines Alpha sériques (1).
de plus, P. aeruginosa infecte les animaux. Dans une expérience, injection intraveineuse de P virulent., aeruginosa a été injecté à des souris et ces animaux sont généralement morts dans les 24-48 heures. Lorsqu’une dose plus petite était injectée, des signes caractéristiques d’infection tels qu’une perte de poids, des lésions focales dans le foie, la rate et les reins, suivis d’un décès dans les 3 à 10 jours, se produisaient. P. aeruginosa a également été trouvé pour provoquer des épidémies de pneumonie chez les cobayes, et bien qu’il attaque également les plantes, peu de recherches ont été faites dans ce domaine (22).
Pseudomonas aeruginosa est un pathogène opportuniste omniprésent dans l’environnement. Les infections épidermiques résultent souvent de P., aeruginosa s’infiltrant à travers la première ligne de défense d’un hôte humain, pénétrant dans le corps par la peau sur le site d’une plaie ouverte. P. aeruginosa est un membre commun des communautés bactériennes hospitalières où il peut infecter les personnes immunodéprimées, y compris les victimes de brûlures. P. aeruginosa est une source de bactériémie chez les brûlés . Suite à de graves lésions cutanées, la prévalence de P. aeruginosa dans l’environnement augmente la probabilité que l’organisme accède à la circulation sanguine à travers le tissu épidermique profond exposé de la victime de la brûlure ., Des recherches antérieures sur les défenses de l’hôte médiées par les anticorps indiquent que le cinquième jour après la brûlure initiale, l’expression du récepteur Fc est réduite dans les leucocytes polymorphonucléaires (PMNs). Sans le récepteur Fc, la chimiotaxie PMN est considérablement réduite et les pmn deviennent moins efficaces pour prévenir l’infection .
P. aeruginosa peut être transmis à un hôte via des fomites, des vecteurs et des travailleurs hospitaliers qui sont des porteurs potentiels de souches de l’agent pathogène résistantes aux antibiotiques. En outre, toute P., aeruginosa déjà présent sur la peau d’une victime de brûlure avant la blessure peut se transformer d’un organisme inoffensif à la surface de la peau à une source d’infection dans la circulation sanguine et les tissus corporels du même individu .
Les pili et flagelles de P. aeruginosa jouent un rôle vital dans l’infection des brûlures et des plaies . L’infection contrôlée de brûlures sur des modèles animaux et végétaux avec des souches de P. aeruginosa dépourvues de pili et de flagelles montre une tendance à la diminution de la virulence., Sans ces facteurs de virulence morphologiques, les bactéries présentent un taux de survie considérablement diminué au site de la plaie et une capacité de dissémination réduite dans l’organisme hôte . La propagation de P. aeruginosa dans les organismes hôtes dépend également de la production d’élastase du micro-organisme et d’autres mécanismes de protéase. L’élastase bactérienne et d’autres protéases bactériennes dégradent les protéines de l’hôte, y compris les protéines structurelles dans les membranes, perturbant les barrières physiques de l’hôte contre la propagation de l’infection. L’élastase aide également P., aeruginosa en évitant la cytotoxicité médiée par les anticorps phagocytotiques au site de la plaie en inhibant la chimiotaxie des monocytes .
Identification:
Macro morphologie (odeur):
Large, flat and greenish colonies (2-4 mm in diameter) with irregular edges and typical metallic luster. The color is most visible on for instance TS-agar. Sometimes, a clear hemolysis zone is obtained on blood agar. Has distinctive smell (caramel, strawberry or raspberry soda). Some strains produce a green fluorescent pigment, pyoverdine. Some strains can also produce a blue pigment, pyocyanin.
Micromorphologie:petite tige mobile (0,5-0,8 x 1,5-3 µm) avec un flagelle monotricheux.
– Gramme:
Fig. 65:5.Coloration Gram de Pseudomonas aeruginosa, souche ATCC 27853. Le champ B est un grossissement partiel (3 fois) de A. La longueur de la barre d’échelle correspond à 5 µm. Date: 2011-03-24., G –
métabolisme:est souvent classé comme aérobie, mais peut également exploiter NO3-comme accepteur final d’électrons dans la chaîne respiratoire. Devrait donc être classé comme anaérobie facultative!
Catalase/oxydase:+ / +Tryptophanase-Citrate +, méthyle rouge -, Voges-Proskauer -.
Application à la biotechnologie
P. aeruginosa, ainsi que de nombreux autres Pseudomonas, peuvent dégrader les hydrocarbures aromatiques tels que les méthylbenzènes, qui sont les sous-produits des industries pétrolières et sont couramment utilisés comme solvants pour les émaux et les peintures ainsi que dans la production de médicaments et de produits chimiques., Les méthylbenzènes sont considérés comme des contaminants environnementaux présents dans l’atmosphère, le sous-sol, les sols et les eaux de surface (25). P. aeruginosa peut décomposer le toluène, la forme la plus simple du méthylbenzène. P. aeruginosa dégrade le toluène par oxydation du groupe méthyle en aldéhyde, alcool et acide, qui est ensuite converti en catéchol. Par conséquent, P. aeruginosa peut être utilisé dans la lutte contre la pollution (26).,
recherche actuelle
effet des vols spatiaux sur L’Expression et la Virulence des gènes microbiens (Microbe)
currently la National Aeronautics and Space Administration (NASA) et le Biodesign Institute de L’Arizona State University mènent actuellement un projet de recherche appelé Microbe Experiment., Dans cette expérience, trois agents pathogènes microbiens Pseudomonas aeruginosa, Salmonella typhimurium et Candida albicans sont amenés dans l’espace pour voir comment leurs réponses génétiques et leur virulence changent. Ces trois microbes ont été considérés comme une menace potentielle pour la santé des astronautes, car P. aeruginosa avait contaminé le système d’eau du vaisseau spatial et infecté un membre d’équipage pendant L’ère Apollo., Ainsi, comprendre leur adaptation et leur virulence en microgravité donnera aux scientifiques plus d’informations sur l’environnement spatial de l’équipage et préparera mieux les astronautes aux futures explorations spatiales. Les microbes ont été placés dans des chambres de culture autonomes et lors de leur retour sur terre, un tiers de l’échantillon sera utilisé pour des études de virulence tandis que le reste sera maintenu congelé à-80oC., Parce qu’il s’agit d’un projet de recherche en cours, il n’y a pas eu de résultats, mais les scientifiques de la NASA ont bon espoir que cette étude conduira à de nouvelles découvertes de vaccins contre ces microbes ici sur Terre et pendant les vols spatiaux (27).
La combinaison de la PCR et de la sérologie augmente le diagnostic de la colonisation/Infection de Pseudomonas aeruginosa dans la fibrose kystique
–Les méthodes de culture microbiologique sont souvent utilisées pour le diagnostic précoce de L’infection de P. aeruginosa chez les patients atteints de fibrose kystique (FK). Ces méthodes, cependant, ont quelques inconvénients parce que P., aeruginosa pourrait ne pas être détecté car l’infection initiale est généralement de faible densité. Il a ensuite été proposé que la sérologie et la réaction en chaîne par polymérase (PCR) pourraient être de meilleures techniques pour détecter le stade précoce de L’infection à P. aeruginosa chez les enfants atteints de mucoviscidose. L’expérience a été réalisée en collectant des expectorations et du sérum chez 87 enfants de la FC âgés en moyenne de 9,7 ans. Ensuite, 1) PCR a été réalisée sur les expectorations, ciblant le gène de la mannose déshydrogénase de P. aeruginosa algD GDP.2) la sérologie a été réalisée contre les antigènes de P. aeruginosa: exotoxine A, élastase et protéase alcaline.,3) une combinaison de PCR et de sérologie a été réalisée.Lors de l’examen des résultats, l’utilisation de la PCR ou de la méthode sérologique seule n’a pas produit de différence statistiquement significative par rapport aux méthodes de culture microbiologique. La combinaison de la PCR et de la sérologie, cependant, a identifié beaucoup plus de patients que l’une des deux méthodes seules. Par conséquent, une méthode combinée incluant la PCR sera une technique précise à utiliser dans le diagnostic précoce de la colonisation de P. aeruginosa chez les patients atteints de mucoviscidose (28).,
l’analyse génomique révèle que la virulence de Pseudomonas aeruginosa est combinatoire
–la comparaison entre la souche P. aeruginosa PA01 et la souche plus virulente P. aeruginosa PA14 a été faite pour identifier de nouveaux gènes de virulence. Tout d’abord, le séquençage du génome shotgun a été effectué sur PA14 en utilisant 65 800 plasmides avec des fragments de 2-4 kb D’ADN PA14. Ensuite, une méthode PCR à longue distance a été mise en œuvre pour déterminer si certains génomes de P. aeruginosa sont similaires aux génomes PA01 ou PA14. Il a été constaté que bien que PA14 gemone (6.5 Mbp) est un peu plus grand que celui de PA01 (6.,3 Mbp), les génomes PA14 et PA01 sont très similaires. Il y avait 58 grappes de gènes de PA14 qui manquaient dans PA01 et il a été supposé que certains de ces gènes sont ce qui rend PA14 beaucoup plus virulent que PA01. Cependant, le génomotypage par microréseaux de 18 souches diverses dans le modèle de C. elegans a montré que ces 58 clusters de gènes PA14 n’étaient pas corrélés à la virulence de ces souches. On a donc conclu que la virulence de P. aeruginosa est à la fois combinatoire et multifactorielle et que les gènes requis pour qu’une souche soit pathogène ne le sont pas pour la virulence d’autres souches (29).,

des recherches également effectuées dans un laboratoire de microbiologie de L’Université Loyola de Chicago ont conclu que le Pseudomonas aeruginosa développe un pigment fluorescent jaune verdâtre dans le bouillon nutritif et l’hydrolyse de la caséine. Après avoir placé ce pigment fluorescent sous la lumière UV, nous avons observé un pigment bleu / vert fluorescent dans le tube à essai. (35)
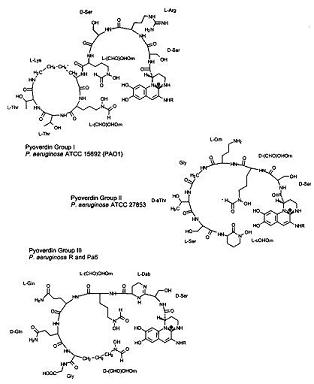
sous carence en fer, un pigment fluorescent vert jaunâtre se développe à la suite de pyoverdines, un terme nommé par Turfreijer pour un groupe de composés ayant un chromophore acide (1S)-5-amino-2,3-dihydro-8,9-dihydroxy-pyrimido-chinolin-1 – carboxylique. La Figure 6A montre les différents types de groupes Pyoverdines qui peuvent être réalisés sur des variations de leur chaîne peptidique. Ces composés pigmentaires ne poussent que sous limitation de fer dans un milieu de croissance. La Figure 6A montre les trois sous-groupes sv différents de Pyoverdine de P. aeruginosa., Étant donné que ces trois structures pyoverdines (également connues sous le nom de ferri-pyoverdines) ne sont produites par aucune autre espèce de Pseudomonas, elles peuvent être un moyen rapide d’identifier la bactérie spécifique, Pseudomonas aeruginos. (34)
1) Lederberg, Joshua et coll. Les Pseudomonas. Encyclopédie de microbiologie. Deuxième Édition. Volume 3. San Diego, 2000. p. 876-891.
3) Botzenhardt, K., et Doring, G. l’Écologie et l’épidémiologie de Pseudomonas aeruginosa. Pseudomonas aeruginosa en tant qu’agent pathogène opportuniste. 1993. p. 1-7.
4) Fick, R., Pseudomonas aeruginosa—the Microbial Hyena and Its Role in Disease: An Introduciton. Pseudomonas aeruginosa: The Opportunist. 1993. p. 1-6.
5) National Center for Biotechnology Information site
6) Gilardi, G. Cultural and Biochemical Aspects for Identification of Glucose-Nonfermenting Gram-Negative Rods. Nonfermenting Gram-Negative Rods. 1985. p.17-24.
8) Craig, W., and Ebert, S. Antimirobial Therapy in Pseudomonas aeruginosa Infections. Pseudomonas aeruginosa Infections and Treatment. 1994. p. 470-491.
9) Pseudomonas Genome Database
11) P., aeruginosa PA14 Genomic Sequencing Project
13) Delden, C. Virulence Fators in Pseudomonas aeruginosa. Pseudomonas. 2004. p. 1-7.
14) Cox, C. Iron and the Virulence of Pseudomonas aeruginosa. Pseudomonas aeruginosa: The Opportunist. 1993. p. 41-45.
15) Rabaey, K., and Verstraete, W. « Microbial Fuel Cells: novel biotechnology for enegy generation”. TrendS in Biotechnology. 2005. Volume 23.
16) Rojo, F., and Dinamarca, A. Catabolite Repression and Physiological Control. Pseudomonas. 2004. p. 365-366.
17) Valls, M., Cases, I., and Lorenzo, V., Transcription médiée par des promoteurs rpoN-dépendants. Les Pseudomonas. 2004. p. 398-302.
18), le Centre de Contrôle des Maladies et la Prévention
19), le Centre de Biofilm Ingénierie
20) Brown, M., et Simith, A. Agents Antimicrobiens et les Biofilms. Implications médicales des Biofilms. 2003. p. 36-38.
21) Irvin, Randall. Fixation et colonisation de Pseudomonas aerugionsa: rôle des Structures de Surface. ‘Pseudomonas aeruginosa est un Pathogène Opportuniste. 1993. p. 19-36.
22) Lowbury, E. importance biologique de Pseudomonas aeruginosa: aspects médicaux., Génétique et biochimie de Pseudomonas. 1975. p. 37-43.
23) Holden, M., et Williams, P. « quorum Sensing ». Encyclopédie des Sciences de la vie. 2001.
25) Pieper, D., Stadler-Fritzche, K., Scholomann, M., et Knackmuss, H. le Métabolisme de la 2-Chloro-4-Methylphenoxyacetate par Alcaligenes eutrophus JMP 134: Implications pour la Dégradation du Chloro – Méthyl-Aromatiques Substitués par ortho le Clivage. Pseudomonas Biologie Moléculaire et de la Biotechnologie. 1992. p. 268-272.,
27) The National Aeronautics and Space Administration
36) édité par des étudiants: Katie Bates et Ashley Mores de M Glogowski à L’Université Loyola. Lyczak, JB, Canon, CL, Jetée, GB. « Établissement de L’infection Pseudomonas aeruginosa: leçons d’un opportuniste polyvalent”. Microbes et Infection. 2000. Volume 2. Numéro 9. p. 1051-1060.
37) « VetBact. »VetBact. N. p., n.d. Web.,
écrit par Chelsea Dao, une étudiante de Rachel Larsen
édité par KLB
édité par des étudiants: Vivek Brahmbhatt et Varun Garg / Michelle Chua et Safi Khan de Mary Glogowski à L’Université Loyola, Irina Rojas et Aaron Beguelin au Hamilton College