jusqu’à présent, toutes nos réactions ont eu lieu dans des conditions idéales. Cependant, les conditions idéales n’existent pas dans la vie réelle. Les réactifs peuvent être impurs, les réactions peuvent ne pas aller à la fin, ou les réactions données peuvent avoir à rivaliser avec plusieurs réactions secondaires plus petites. En fait, en laboratoire, si vous obtenez 60% de la quantité attendue de produit, cela est considéré comme très bon.
Maintenant, nous allons parler de la terminologie. La quantité calculée ou attendue de produit est appelée le rendement théorique., La quantité de produit réellement produite est appelée le rendement réel. Lorsque vous divisez le rendement réel par le rendement théorique, vous obtenez un pourcentage décimal connu sous le nom de rendement en pourcentage d’une réaction.
% De Rendement = 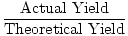 |
une Fois encore, il est temps pour un exemple de problème:
Problème: Quel est le pourcentage de rendement de la réaction suivante si 60 g de CaCO3 est chauffé à donner à 15 grammes de CaO?,
| CaCO3→CaO + CO2 |
la Solution: Idéalement, combien de grammes de CaO doit être produite? Vérifiez d’abord que l’équation est équilibrée; elle l’est. Convertissez maintenant en taupes, en fonction de la quantité de CaCO3 présente.
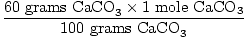 × ×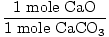 = 0.6 mole CaO = 0.6 mole CaO |
Combien de grammes est-ce?,
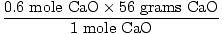 = 33.6 grammes CaO = 33.6 grammes CaO |
Donc, idéalement, de 33,6 grammes de CaO doivent avoir été produits dans cette réaction. C’est le rendement théorique. Cependant, le problème nous dit que seulement 15 grammes. 15 grammes est le rendement réel. Il est maintenant simple de trouver un pourcentage de rendement.