resultados de aprendizaje
- derivar las configuraciones electrónicas de estado fundamental predichas de los átomos
- Identificar y explicar las excepciones a las configuraciones electrónicas predichas para átomos e iones
- relacionar las configuraciones electrónicas con las clasificaciones de elementos en la Tabla periódica
números cuánticos para determinar cómo los orbitales atómicos se relacionan entre sí., Esto nos permite determinar qué orbitales están ocupados por electrones en cada átomo. La disposición específica de los electrones en los orbitales de un átomo determina muchas de las propiedades químicas de ese átomo.
energías orbitales y estructura atómica
la energía de los orbitales atómicos aumenta a medida que aumenta el número cuántico principal, n., En cualquier átomo con dos o más electrones, la repulsión entre los electrones hace que las energías de las subcapas con diferentes valores de l difieran de modo que la energía de los orbitales aumenta dentro de una capa en el orden s < p < d < f. La Figura 1 muestra cómo se relacionan estas dos tendencias en el aumento de la energía. El orbital 1s en la parte inferior del diagrama es el orbital con electrones de menor energía., La energía aumenta a medida que nos movemos hasta los orbitales 2s y luego 2P, 3s y 3p, mostrando que el valor creciente de n tiene más influencia en la energía que el valor creciente de l para átomos pequeños. Sin embargo, este patrón no es válido para átomos más grandes. El orbital 3d es más alto en energía que el orbital 4s. Tales solapamientos continúan ocurriendo con frecuencia a medida que avanzamos en el gráfico.

la Figura 1. Diagrama de nivel de energía generalizado para orbitales atómicos en un átomo con dos o más electrones (no a escala).,
Los electrones en átomos sucesivos en la Tabla periódica tienden a llenar los orbitales de baja energía primero. Por lo tanto, muchos estudiantes encuentran confuso que, por ejemplo, los orbitales 5p se llenen inmediatamente después del 4D e inmediatamente antes del 6s. el orden de llenado se basa en los resultados experimentales observados y ha sido confirmado por cálculos teóricos. Como el número cuántico principal, n, aumenta el tamaño del orbital aumenta y los electrones pasan más tiempo lejos del núcleo., Por lo tanto, la atracción hacia el núcleo es más débil y la energía asociada con el orbital es mayor (menos estabilizada). Pero este no es el único efecto que tenemos que tener en cuenta. Dentro de cada capa, a medida que aumenta el valor de l, los electrones son menos penetrantes (lo que significa que hay menos densidad electrónica encontrada cerca del núcleo), en el orden s > p > d > f., Los electrones que están más cerca del núcleo repelen ligeramente a los electrones que están más lejos, compensando ligeramente las atracciones más dominantes del electrón–núcleo (recordemos que todos los electrones tienen cargas -1, pero los núcleos tienen cargas + Z). Este fenómeno se llama blindaje y se discutirá con más detalle en la siguiente sección. Los electrones en orbitales que experimentan más blindaje están menos estabilizados y, por lo tanto, son más altos en energía., Para orbitales pequeños (1s A 3p), el aumento de energía debido a n es más significativo que el aumento debido a l; sin embargo, para orbitales más grandes las dos tendencias son comparables y no se pueden predecir simplemente. Discutiremos los métodos para recordar el orden observado.
La disposición de los electrones en los orbitales de un átomo se denomina configuración electrónica del átomo., Describimos una configuración electrónica con un símbolo que contiene tres piezas de información (Figura 2):
- El número de la cáscara cuántica principal, n,
- La letra que designa el tipo orbital (la subcapa, l), y
- Un número superíndice que designa el número de electrones en esa subcapa en particular.
por ejemplo, la notación 2p4 (léase «dos–p–cuatro») indica cuatro electrones en una subcapa p (l = 1) con un número cuántico principal (n) de 2. La notación 3d8 (léase «tres–d–ocho») indica ocho electrones en la subcapa d (i. e.,, l = 2) del shell principal para el cual n = 3.
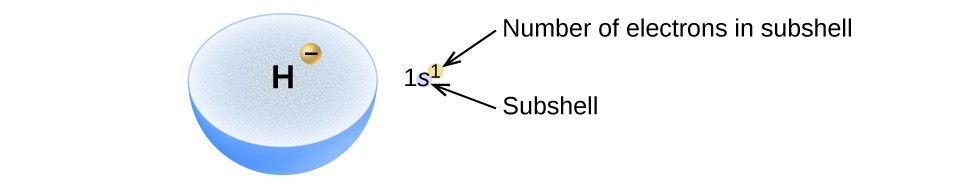
la Figura 2. El diagrama de una configuración electrónica especifica la subcapa (valor n y l, con símbolo de letra) y el número superíndice de electrones.
El Principio de Aufbau
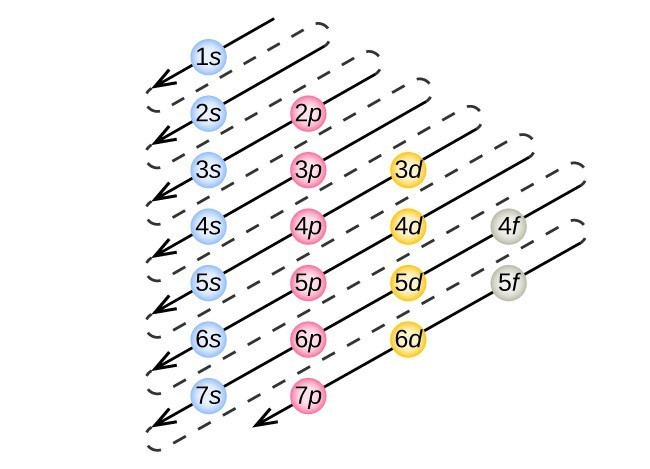
la Figura 3. La flecha conduce a través de cada subcapa en el orden de llenado apropiado para las configuraciones electrónicas. Este gráfico es fácil de construir. Simplemente haga una columna para todos los orbitales s con cada shell n en una fila separada., Repita para p, d y f. asegúrese de incluir solo orbitales permitidos por los números cuánticos (no 1p o 2d, y así sucesivamente). Finalmente, dibuja líneas diagonales de arriba a abajo como se muestra.
para determinar la configuración electrónica de cualquier átomo en particular, podemos «construir» las estructuras en el orden de los números atómicos. Comenzando con hidrógeno, y continuando a través de los períodos de la Tabla periódica, agregamos un protón a la vez al núcleo y un electrón a la subcapa adecuada hasta que hayamos descrito las configuraciones electrónicas de todos los elementos.,
Este procedimiento se llama principio Aufbau, de la palabra alemana Aufbau («construir»). Cada electrón añadido ocupa la subcapa de menor energía disponible (en el orden mostrado en la Figura 1), sujeto a las limitaciones impuestas por los números cuánticos permitidos según el principio de exclusión de Pauli. Los electrones entran en las subcapas de mayor energía solo después de que las subcapas de menor energía se hayan llenado a su capacidad. La figura 3 ilustra la forma tradicional de recordar el orden de llenado de los orbitales atómicos., Dado que la disposición de la Tabla periódica se basa en las configuraciones electrónicas, la Figura 4 proporciona un método alternativo para determinar la configuración electrónica. El orden de llenado simplemente comienza en hidrógeno e incluye cada subcapa a medida que avanza en orden z creciente. Por ejemplo, después de llenar el bloque 3p hasta Ar, vemos que el orbital será 4s (K, Ca), seguido por los orbitales 3d.
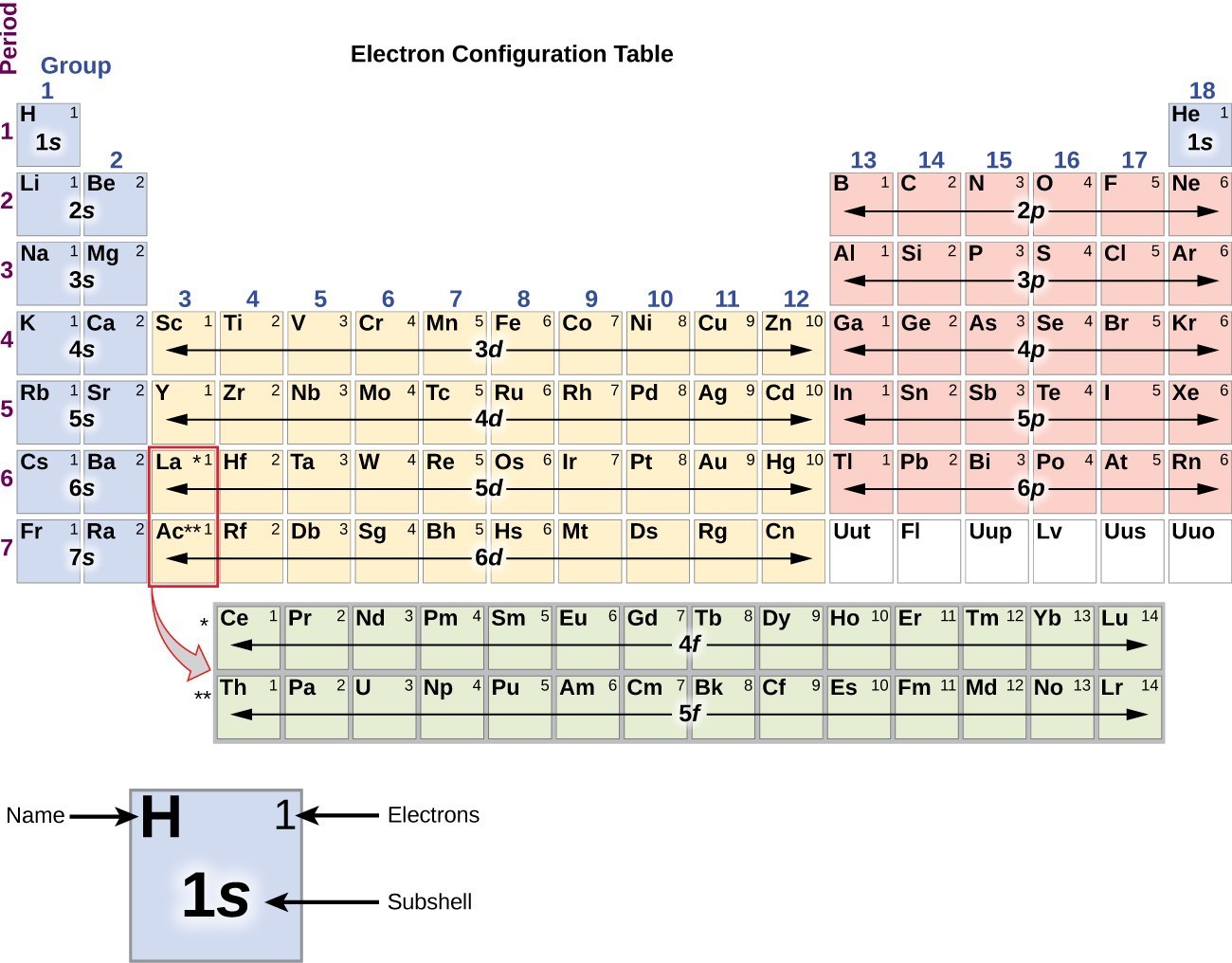
la Figura 4. Esta tabla periódica muestra la configuración electrónica para cada subcapa., Al «acumularse» a partir de hidrógeno, esta tabla se puede usar para determinar la configuración electrónica de cualquier átomo en la Tabla periódica.
ahora construiremos la configuración electrónica del estado fundamental y el diagrama orbital para una selección de átomos en el primer y segundo períodos de la Tabla periódica. Los diagramas orbitales son representaciones pictóricas de la configuración electrónica, mostrando los orbitales individuales y la disposición de pares de electrones. Comenzamos con un solo átomo de hidrógeno (número atómico 1), que consiste en un protón y un electrón., Refiriéndose a la Figura 3 o figura 4, esperaríamos encontrar el electrón en el orbital 1s. Por convención, el valor {m}_{s}=+\frac{1}{2} generalmente se llena primero. La configuración electrónica y el diagrama orbital son:

después del hidrógeno está el gas noble helio, que tiene un número atómico de 2. El átomo de helio contiene dos protones y dos electrones. El primer electrón tiene los mismos cuatro números cuánticos que el electrón átomo de hidrógeno (n = 1, l = 0, ml = 0, {m}_{s}=+\frac{1}{2} ). El segundo electrón también entra en el orbital 1s y llena ese orbital., El segundo electrón tiene los mismos números cuánticos n, l y ml, pero debe tener el número cuántico de espín opuesto, {m}_{s}=-\frac{1}{2}. Esto está de acuerdo con el principio de exclusión de Pauli: no hay dos electrones en el mismo átomo que puedan tener el mismo conjunto de cuatro números cuánticos. Para diagramas orbitales, esto significa que dos flechas van en cada caja (representando dos electrones en cada orbital) y las flechas deben apuntar en direcciones opuestas (representando giros emparejados)., La configuración electrónica y el diagrama orbital del helio son:

la capa n = 1 está completamente llena en un átomo de helio.
el siguiente átomo es el metal alcalino litio con un número atómico de 3. Los dos primeros electrones en litio llenan el orbital 1s y tienen los mismos conjuntos de cuatro números cuánticos que los dos electrones en helio. El electrón restante debe ocupar el orbital de la siguiente energía más baja, el orbital 2s (Figura 3 o figura 4)., Así, la configuración electrónica y el diagrama orbital del litio son:

un átomo del metal alcalinotérreo berilio, con un número atómico de 4, contiene cuatro protones en el núcleo y cuatro electrones que rodean el núcleo. El cuarto electrón llena el espacio restante en el orbital 2s.
Un átomo de boro (número atómico 5) contiene cinco electrones. La capa n = 1 está llena de dos electrones y tres electrones ocuparán la capa n = 2., Debido a que cualquier subcapa s puede contener solo dos electrones, el quinto electrón debe ocupar el siguiente nivel de energía, que será un orbital 2p. Hay tres orbitales degenerados 2p (ml = -1, 0, +1)y el electrón puede ocupar cualquiera de estos orbitales P. Al dibujar diagramas orbitales, incluimos cajas vacías para representar cualquier Orbital vacío en la misma subcapa que estamos llenando.

de Carbono (número atómico 6) tiene seis electrones. Cuatro de ellos llenan los orbitales 1s y 2s. Los dos electrones restantes ocupan la subcapa 2p., Ahora tenemos la opción de llenar uno de los orbitales 2p y emparejar los electrones o de dejar los electrones sin emparejar en dos orbitales p diferentes, pero degenerados. Los orbitales se llenan como se describe en la regla de Hund: la configuración de energía más baja para un átomo con electrones dentro de un conjunto de orbitales degenerados es que tiene el número máximo de electrones no emparejados. Por lo tanto, los dos electrones en los orbitales de carbono 2p tienen números cuánticos n, L y ms idénticos y difieren en su número cuántico ml (de acuerdo con el principio de exclusión de Pauli)., La configuración electrónica y el diagrama orbital para el carbono son:

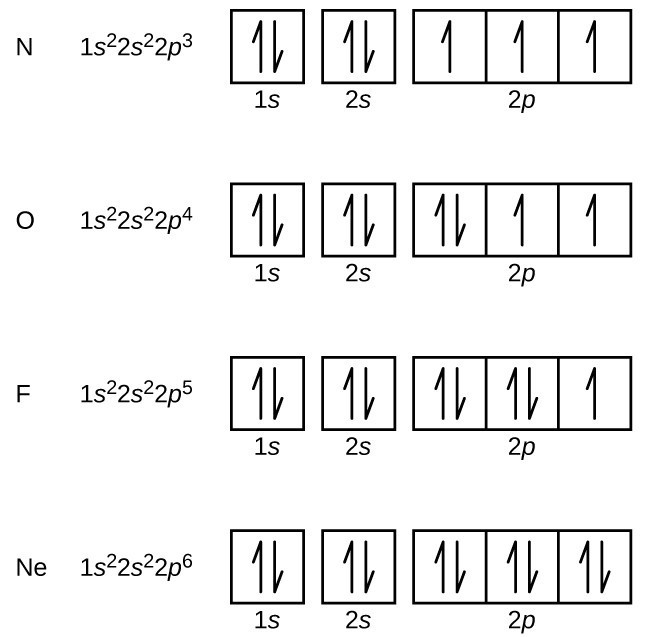
El nitrógeno (número atómico 7) llena las subcapas 1s y 2s y tiene un electrón en cada uno de los tres orbitales 2p, de acuerdo con la regla de Hund. Estos tres electrones tienen espines no apareados. El oxígeno (número atómico 8) tiene un par de electrones en cualquiera de los orbitales 2p (los electrones tienen espines opuestos) y un solo electrón en cada uno de los otros dos. El flúor (número atómico 9) tiene solo un orbital 2p que contiene un electrón no emparejado., Todos los electrones en el neón de gas noble (número atómico 10) están emparejados, y todos los orbitales en las capas n = 1 y n = 2 están llenos. Las configuraciones electrónicas y diagramas orbitales de estos cuatro elementos son:
el sodio del metal alcalino (número atómico 11) tiene un electrón más que el átomo de neón. Este electrón debe entrar en la subcapa de menor energía disponible, el orbital 3s, dando una configuración 1s22s22p63s1., Los electrones que ocupan el(los) orbital (s) de la capa más externa (el valor más alto de n) se llaman electrones de Valencia, y los que ocupan los orbitales de la capa interna se llaman electrones del núcleo (Figura 5). Dado que las capas de electrones del núcleo corresponden a configuraciones de electrones de gas noble, podemos abreviar las configuraciones de electrones escribiendo el gas noble que coincide con la configuración de electrones del núcleo, junto con los electrones de Valencia en un formato condensado. Para nuestro ejemplo de sodio, el símbolo representa electrones centrales, (1s22s22p6) y nuestra configuración abreviada o condensada es 3s1.,

la Figura 5. Una configuración electrónica abreviada del núcleo (derecha) reemplaza los electrones del núcleo con el símbolo de gas noble cuya configuración coincide con la configuración electrónica del núcleo del otro elemento.
del mismo modo, la configuración abreviada de litio se puede representar como 2s1, donde representa la configuración del átomo de helio, que es idéntica a la de la cubierta interna llena de litio. Escribir las configuraciones de esta manera enfatiza la similitud de las configuraciones de litio y sodio., Ambos átomos, que están en la familia del metal alcalino, tienen solo un electrón en una subcapa de Valencia Fuera de un conjunto lleno de capas internas.
\begin{array}{l}\text{Li:}\left2{s}^{1}\\ \text{Na:}\left3{s}^{1}\end{array}
El magnesio del metal alcalinotérreo (número atómico 12), con sus 12 electrones en una configuración 3s2, es análogo a su miembro de la familia berilio, 2s2. Ambos átomos tienen una subcapa s llena fuera de sus capas internas llenas., El aluminio (número atómico 13), con 13 electrones y la configuración electrónica 3s23p1, es análogo a su miembro de la familia boro, 2s22p1.
las configuraciones electrónicas de silicio (14 electrones), fósforo (15 electrones), azufre (16 electrones), cloro (17 electrones) y argón (18 electrones) son análogas en las configuraciones electrónicas de sus capas externas a sus correspondientes miembros de la familia carbono, nitrógeno, oxígeno, flúor y neón, respectivamente, excepto que el número cuántico principal de la capa externa de los elementos más pesados ha aumentado en uno a n = 3., La figura 6 muestra la configuración electrónica de menor energía, o estado fundamental, para estos elementos, así como para los átomos de cada uno de los elementos conocidos.

la Figura 6. Esta versión de la Tabla periódica muestra la configuración electrónica de la capa exterior de cada elemento. Tenga en cuenta que en cada grupo, la configuración es a menudo similar.
cuando llegamos al siguiente elemento de la Tabla periódica, el potasio del metal alcalino (número atómico 19), podríamos esperar que comenzaríamos a agregar electrones a la subcapa 3d., Sin embargo, toda la evidencia química y física disponible indica que el potasio es como el litio y el sodio, y que el siguiente electrón no se agrega al nivel 3d, sino que se agrega al nivel 4s (Figura 6). Como se discutió anteriormente, el orbital 3d sin nodos radiales es más alto en energía porque es menos penetrante y más protegido del núcleo que el 4S, que tiene tres nodos radiales. Por lo tanto, el potasio tiene una configuración electrónica de 4s1. Por lo tanto, el potasio corresponde a Li Y Na en su configuración de cáscara de Valencia., El siguiente electrón se añade para completar la subcapa 4s y el calcio tiene una configuración electrónica de 4s2. Esto le da al calcio una configuración electrónica de la capa exterior correspondiente a la del berilio y el magnesio.
comenzando con el escandio de metal de Transición (número atómico 21), electrones adicionales se agregan sucesivamente a la subcapa 3d. Esta subcapa se llena a su capacidad con 10 electrones (recuerde que para l = 2, hay 2L + 1 = 5 valores de ml, lo que significa que hay cinco orbitales d que tienen una capacidad combinada de 10 electrones). El subshell 4p se rellena a continuación., Tenga en cuenta que para tres series de elementos, escandio (Sc) a través de cobre (Cu), itrio (y) a través de plata (Ag), y lutecio (Lu) a través de oro (Au), un total de 10 electrones d se añaden sucesivamente a la cáscara (n – 1) junto a la cáscara n para traer esa cáscara (n – 1) de 8 a 18 electrones. Para dos series, lantano (La) A lutecio (Lu) y actinio (Ac) a lawrencio (Lr), 14 electrones f (L = 3, 2L + 1 = valores de 7 ml; por lo tanto, siete orbitales con una capacidad combinada de 14 electrones) se agregan sucesivamente a la capa (n – 2) para llevar esa capa de 18 electrones a un total de 32 electrones.,
ejemplo 1: números cuánticos y configuraciones electrónicas
¿Cuál es la configuración electrónica y el diagrama orbital para un átomo de fósforo? ¿Cuáles son los cuatro números cuánticos para el último electrón añadido?
Compruebe su aprendizaje
identifique los átomos de las configuraciones electrónicas dadas:
- 4s23d5
- 5s24d105p6.
La tabla periódica puede ser una poderosa herramienta en la predicción de la configuración electrónica de un elemento. Sin embargo, encontramos excepciones al orden de llenado de orbitales que se muestran en la Figura 3 o la Figura 4., Por ejemplo, las configuraciones electrónicas (mostradas en la Figura 6) de los metales de Transición cromo (Cr; número atómico 24) y cobre (Cu; número atómico 29), entre otros, no son las que esperaríamos. En general, tales excepciones implican subcapas con energía muy similar, y pequeños efectos pueden conducir a cambios en el orden de llenado.
en el caso de Cr y Cu, encontramos que las subcapas medio llenas y completamente llenas aparentemente representan condiciones de estabilidad preferida., Esta estabilidad es tal que un electrón se desplaza del 4S al orbital 3d para obtener la estabilidad adicional de una subcapa 3D medio llena (en Cr) o una subcapa 3D llena (en Cu). También se producen otras excepciones. Por ejemplo, se prevé que el niobio (Nb, número atómico 41) tenga la configuración electrónica 5s24d3. Experimentalmente, observamos que su configuración electrónica de estado fundamental es en realidad 5s14d4., Podemos racionalizar esta observación diciendo que las repulsiones electrón–electrón experimentadas al emparejar los electrones en el orbital 5s son más grandes que la brecha en energía entre los orbitales 5s y 4d. No hay un método simple para predecir las excepciones para los átomos donde la magnitud de las repulsiones entre electrones es mayor que las pequeñas diferencias de energía entre las subcapas.,
configuraciones electrónicas y la Tabla periódica
como se describió anteriormente, la Tabla periódica ordena los átomos en función del aumento del número atómico para que los elementos con las mismas propiedades químicas recurran periódicamente. Cuando se agregan sus configuraciones electrónicas a la tabla (Figura 6), también vemos una recurrencia periódica de configuraciones electrónicas similares en las capas externas de estos elementos. Debido a que se encuentran en las capas externas de un átomo, los electrones de Valencia desempeñan el papel más importante en las reacciones químicas., Los electrones exteriores tienen la energía más alta de los electrones en un átomo y son más fácilmente perdidos o compartidos que los electrones centrales. Los electrones de Valencia son también el factor determinante en algunas propiedades físicas de los elementos.
Los elementos en cualquier grupo (o columna) tienen el mismo número de electrones de Valencia; los metales alcalinos litio y sodio tienen cada uno solo un electrón de Valencia, los metales alcalinotérreos berilio y magnesio tienen cada uno dos, y los halógenos flúor y cloro tienen cada uno siete electrones de Valencia., La similitud en las propiedades químicas entre elementos del mismo grupo ocurre porque tienen el mismo número de electrones de Valencia. Es la pérdida, ganancia o intercambio de electrones de Valencia lo que define cómo reaccionan los elementos.
es importante recordar que la Tabla periódica se desarrolló sobre la base del comportamiento químico de los elementos, mucho antes de que estuviera disponible cualquier idea de su estructura atómica. Ahora podemos entender por qué la Tabla periódica tiene la disposición que tiene – la disposición pone elementos cuyos átomos tienen el mismo número de electrones de Valencia en el mismo grupo., Esta disposición se enfatiza en la Figura 6, que muestra en forma de Tabla periódica la configuración electrónica de la última subcapa a ser llenada por el principio de Aufbau. Las secciones coloreadas de la Figura 6 muestran las tres categorías de elementos clasificados por los orbitales que se llenan: grupo principal, transición y elementos de transición interna. Estas clasificaciones determinan qué orbitales se cuentan en la capa de Valencia, o orbitales de mayor nivel de energía de un átomo.,
- Los elementos del grupo principal (a veces llamados elementos representativos) son aquellos en los que el último electrón agregado entra en un orbital s O p en la capa más externa, mostrados en azul y rojo en la Figura 6. Esta categoría incluye todos los elementos no metálicos, así como muchos metales y los elementos semimetálicos intermedios. Los electrones de Valencia para los elementos del grupo principal son aquellos con el nivel n más alto. Por ejemplo, el galio (Ga, número atómico 31) tiene la configuración electrónica 4s23d104p1, que contiene tres electrones de Valencia (subrayados)., Los orbitales d completamente llenos cuentan como electrones de núcleo, no de Valencia.
- Elementos de Transición o metales de Transición. Estos son elementos metálicos en los que el último electrón añadido entra en un orbital D. Los electrones de Valencia (los agregados después de la última configuración de gas noble) en estos elementos incluyen los electrones ns y (n – 1) D. La definición oficial de la IUPAC de elementos de Transición especifica aquellos con orbitales d parcialmente llenos. Por lo tanto, los elementos con orbitales completamente llenos (Zn, Cd, Hg, así como Cu, Ag y Au en la Figura 6) no son técnicamente elementos de Transición., Sin embargo, el término se usa frecuentemente para referirse a todo el bloque d (de color amarillo en la Figura 6), y adoptaremos este uso en este libro de texto.
- Los elementos de transición interna son elementos metálicos en los que el último electrón añadido ocupa un orbital F. Se muestran en verde en la Figura 6. Las capas de Valencia de los elementos internos de Transición consisten en las subcapas (n – 2)f, (n – 1)d y ns., Hay dos series de transición interna:
- La serie de lantánidos: lantánido (La) a través de lutecio (Lu)
- la serie de actínidos: actinidos (Ac) a través de lawrencio (Lr)
lantano y actinio, debido a sus similitudes con los otros miembros de la serie, se incluyen y se utilizan para nombrar la Serie, A pesar de que son metales de transición sin electrones F.
configuraciones electrónicas de iones
hemos visto que los iones se forman cuando los átomos ganan o pierden electrones., Un catión (ion cargado positivamente) se forma cuando uno o más electrones son removidos de un átomo padre. Para los elementos del grupo principal, los electrones que se agregaron en último lugar son los primeros electrones eliminados. Para los metales de transición y los metales de Transición internos, sin embargo, los electrones en el orbital s son más fáciles de eliminar que los electrones d O f, por lo que los electrones NS más altos se pierden, y luego los electrones (n – 1)d O (n – 2)f Se eliminan. Un anión (ion cargado negativamente) se forma cuando uno o más electrones se agregan a un átomo padre. Los electrones añadidos llenan el orden predicho por el principio de Aufbau.,
Ejemplo 2: predicción de configuraciones electrónicas de iones
Cuál es la configuración electrónica y el diagrama orbital de:
- Na+
- P3–
- Al2+
- Fe2+
- Sm3+
primero, escriba la configuración electrónica para cada átomo padre. Hemos elegido mostrar las configuraciones completas y sin abreviar para proporcionar más práctica a los estudiantes que lo deseen, pero listar las configuraciones electrónicas abreviadas del núcleo también es aceptable.,
a continuación, determine si un electrón se gana o se pierde. Recuerde que los electrones están cargados negativamente, por lo que los iones con una carga positiva han perdido un electrón. Para los elementos del grupo principal, el último orbital gana o pierde el electrón. Para los metales de transición, el último orbital s pierde un electrón antes que los orbitales D.
- Na: 1s22s22p63s1. El catión de sodio pierde un electrón, por lo que Na+: 1s22s22p63s1 = Na+: 1s22s22p6.
- P: 1s22s22p63s23p3. El trianión de fósforo gana tres electrones, por lo que P3 -: 1s22s22p63s23p6.
- Al: 1s22s22p63s23p1., Aluminum dication loses two electrons Al2+: 1s22s22p63s23p1 = Al2+: 1s22s22p63s1.
- Fe: 1s22s22p63s23p64s23d6. Iron(II) loses two electrons and, since it is a transition metal, they are removed from the 4s orbital Fe2+: 1s22s22p63s23p64s23d6 = 1s22s22p63s23p63d6.
- Sm: 1s22s22p63s23p64s23d104p65s24d105p66s24f6. Samarium trication loses three electrons. The first two will be lost from the 6s orbital, and the final one is removed from the 4f orbital. Sm3+: 1s22s22p63s23p64s23d104p65s24d105p66s24f6 = 1s22s22p63s23p64s23d104p65s24d105p64f5.,
Compruebe su aprendizaje
¿Qué ion con una carga +2 tiene la configuración electrónica 1s22s22p63s23p63d104s24p64d5? ¿Qué ion con carga +3 tiene esta configuración?
conceptos clave y Resumen
la energía relativa de las subcapas determina el orden en el que se llenan los orbitales atómicos (1s, 2s, 2p, 3s, 3P, 4s, 3d, 4P, y así sucesivamente)., Las configuraciones electrónicas y los diagramas orbitales se pueden determinar aplicando el principio de exclusión de Pauli (no hay dos electrones que puedan tener el mismo conjunto de cuatro números cuánticos) y la regla de Hund (siempre que sea posible, los electrones retienen espines no emparejados en orbitales degenerados).
Los electrones en los orbitales más externos, llamados electrones de Valencia, son responsables de la mayor parte del comportamiento químico de los elementos. En la Tabla periódica, los elementos con configuraciones electrónicas de Valencia análogas generalmente ocurren dentro del mismo grupo., Hay algunas excepciones al orden de llenado previsto, particularmente cuando se pueden formar orbitales a medio o completamente llenos. La Tabla periódica se puede dividir en tres categorías basadas en el orbital en el que se coloca el último electrón a agregar: elementos del grupo principal (orbitales s y p), elementos de Transición (orbitales d) y elementos de transición interna (orbitales f).
Intentarlo
- Lea las etiquetas de varios productos comerciales e identificar los iones monoatómicos de al menos cuatro elementos de transición contenidas en los productos., Escriba las configuraciones electrónicas completas de estos cationes.
- lea las etiquetas de varios productos comerciales e identifique los iones monatómicos de al menos seis elementos principales del grupo contenidos en los productos. Escriba las configuraciones electrónicas completas de estos cationes y aniones.,
- usando la notación completa de subconjuntos (no abreviaturas, 1s22s22p6, etc.), predice la configuración electrónica de cada uno de los siguientes átomos:
- C
- p
- V
- Sb
- Sm
- usando la notación completa de subconjuntos (1s22s22p6, y así sucesivamente), predecir la configuración electrónica de cada uno de los siguientes átomos:
- n
- Si
- Fe
- te
- TB
- Es 1s22s22p6 el símbolo de una propiedad macroscópica o una propiedad microscópica de un elemento? Explica tu respuesta.,
- ¿Qué información adicional necesitamos para responder a la pregunta «Qué ion tiene la configuración electrónica 1s22s22p63s23p6»?,
- dibuje el diagrama orbital para la capa de Valencia de cada uno de los siguientes átomos:
- c
- p
- V
- Sb
- Ru
- utilice un diagrama orbital para describir la configuración electrónica de la capa de Valencia de cada uno de los siguientes átomos:
- n
- Si
- fe
- te
- Mo
- usando la notación completa de subconjuntos (1s22s22p6, y así sucesivamente), predice las configuraciones electrónicas de los siguientes iones.,
- N3–
- Ca2+
- S
- Cs2+
- Cr2+
- Gd3+
- Que el átomo tiene la configuración electrónica 1s22s22p63s23p64s23d104p65s24d2?
- ¿Qué átomo tiene la configuración electrónica 1s22s22p63s23p63d74s2?
- ¿Qué ion con una carga +1 tiene la configuración electrónica 1s22s22p63s23p63d104s24p6? ¿Qué ion con carga -2 tiene esta configuración?
- ¿Cuál de los siguientes átomos contiene solo tres electrones de Valencia: Li, B, N, F, Ne?
- cuál de los siguientes tiene dos electrones no apareados?,
- Mg
- Si
- S
- Ambos Mg y S
- Tanto Si y S.
- Que el átomo se espera que tenga una media llena de 6p subshell?
- ¿Qué átomo se espera que tenga un subshell 4S medio lleno?
- en un área de Australia, el ganado no prosperó a pesar de la presencia de forraje adecuado. Una investigación mostró que la causa era la ausencia de suficiente cobalto en el suelo. El cobalto forma cationes en dos estados de oxidación, Co2+ y Co3+. Escribe la estructura electrónica de los dos cationes.,
- El talio fue utilizado como veneno en la historia de misterio de Agatha Christie » The Pale Horse.»El talio tiene dos formas catiónicas posibles, +1 y + 3. Los compuestos +1 son los más estables. Escribe la estructura electrónica del catión +1 del talio.
- Escribir la configuración electrónica de los siguientes átomos o iones:
- B3+
- O–
- Cl3+
- Ca2+
- Ti
- el Cobalto–60 y el yodo–131 se isótopos radiactivos comúnmente utilizado en medicina nuclear. ¿Cuántos protones, neutrones y electrones hay en los átomos de estos isótopos?, Write the complete electron configuration for each isotope.
- Write a set of quantum numbers for each of the electrons with an n of 3 in a Sc atom.





