je suis Shinichi Morita, chercheur postdoctoral dans le laboratoire de Teruyuki Niimi à L’Institut national de biologie fondamentale, Japon (Fig. 1A, B). Nos intérêts de recherche portent sur les nouveautés évolutives que les insectes ont acquises et sur la façon dont diverses morphologies d’insectes sont apparues au cours de l’évolution (Fig. 1C-P).
Les cornes de coléoptères sont considérées comme une nouveauté évolutive et sont utilisées comme armes pour les combats intraspécifiques entre mâles., Les cornes des scarabées présentent un dimorphisme sexuel chez de nombreux scarabées, et leurs formes, leur Nombre, leur taille et leurs régions de formation sont très divergentes, même parmi les espèces étroitement apparentées (fig. 2). L’élucidation de la façon dont ces caractères nouveaux ont été acquis chez les espèces de Scarabées permettra de mieux comprendre les mécanismes de diversification morphologique au cours de l’évolution. Mon projet postdoc est de comprendre comment les cornes exagérées sont acquises et formées chez les coléoptères rhinocéros Japonais (Trypoxylus dichotomus) (Fig. 2 BIS, B).
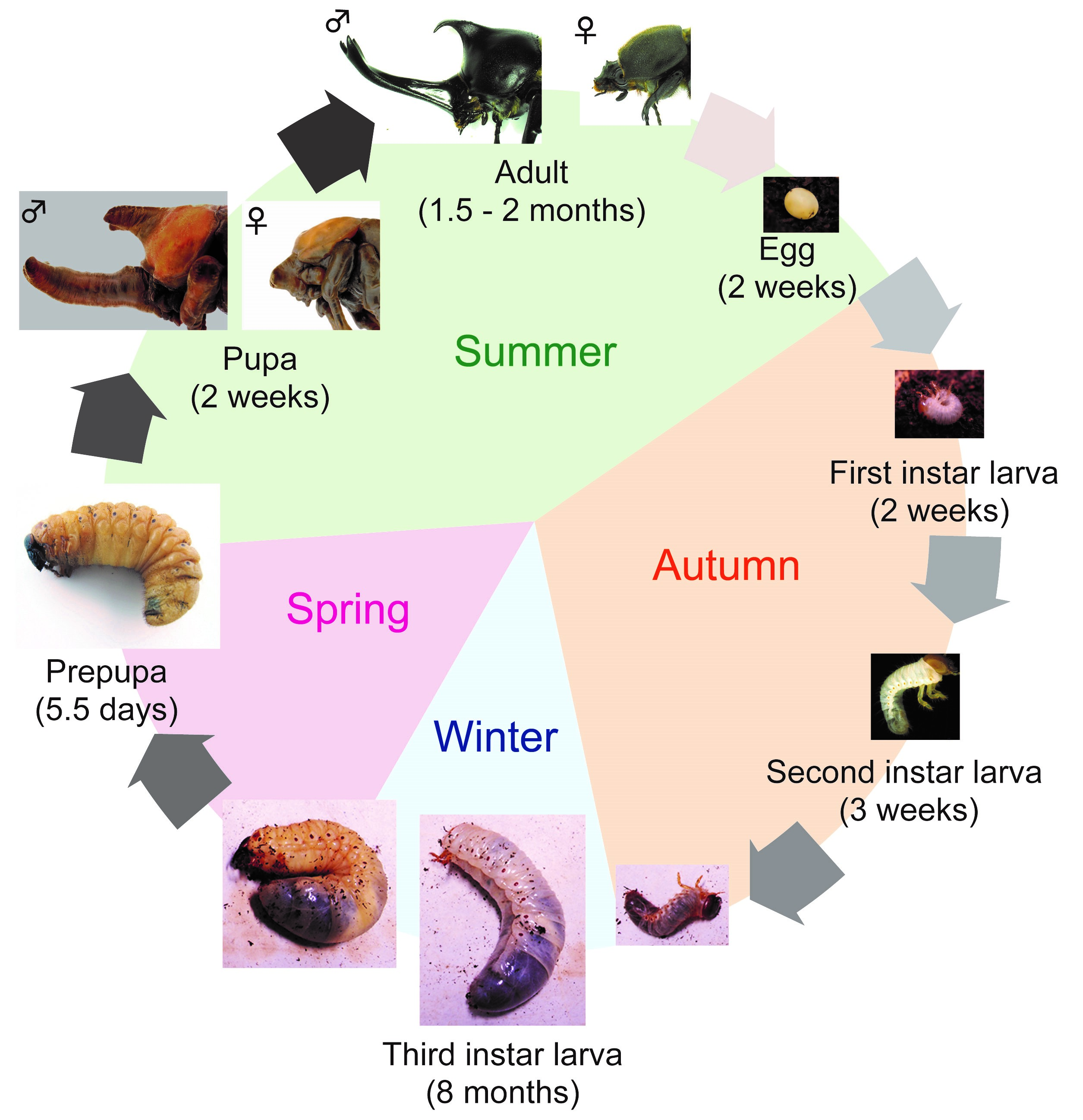
tout d’abord, je vais présenter T. dichotomus. Au Japon, T., dichotomus est un insecte populaire et familier aux enfants et aux adultes, et est vendu comme animal de compagnie dans les grands magasins et les magasins de bricolage pendant l’été. Le nom Japonais de T. dichotomus est Kabuto-mushi, et il est également utilisé comme l’un des mots de saison de « Haiku” (Haiku est un poème Japonais court traditionnel avec dix-sept syllabes dans le modèle de 5-7-5, y compris un mot de saison). T. dichotomus est un insecte holométabole qui a des stades d’œuf, de larve, de pupe et d’adulte. Son cycle de vie est d’environ 12 mois (Fig. 3). Les adultes émergent au début de l’été et pondent dans le sol à la fin de l’été., Les larves éclosent des œufs en environ 2 semaines (Fig. 3, oeuf) et se nourrissent d’humus. La période larvaire est d’environ 8 mois et elles se nymphosent au printemps suivant (Fig. 3, larve du premier troisième stade). À la fin du troisième (dernier) stade, ils font chambre pupale (Fig. 3, Prénymphe). Pendant la période prépupale, des primordiums de corne se forment dans la tête et le thorax. Après environ 2 semaines de pupe (fig. 3, pupe), ils deviennent adultes au début de l’été (Fig. 3, adulte). Les adultes mâles de T. dichotomus ont des cornes exagérées sur la tête et le prothorax (fig. 2A), alors que les femelles n’ont pas ces structures (fig. 2B)., La corne de la tête est en forme de charrue avec une longue tige et bifurquée deux fois à l’extrémité distale, tandis que la corne prothoracique est plus courte que la corne de la tête et bifurquée une fois à l’extrémité distale.
ici, je partage mes activités quotidiennes en laboratoire. Comme mentionné ci-dessus, comme le cycle de vie de T. dichotomus est d’un an, notre vie quotidienne diffère selon la saison. En avril, nous achetons environ 3 000 à 4 000 larves de dernier stade de T., dichotomus du fournisseur d’insectes (Fig. 4A). Avec l’aide des membres de notre laboratoire, le sexe de ces larves est déterminé (Fig. 4B) et ils sont emballés individuellement dans une bouteille remplie de tapis d’élevage (Fig. 4C). Ils sont conservés à 10 ° C jusqu’à leur utilisation (fig. 4D). Par conséquent, nous pouvons utiliser T. dichotomus comme matériau expérimental en toute saison.

(a) larves achetées du dernier stade de T. dichotomus., (B) les larves mâles et femelles sont discriminées par la présence (mâle) ou l’absence (femelle) de L’organe de Herold. C) les larves sont élevées individuellement dans un récipient (140 mm de hauteur et 95 mm de diamètre pour les mâles, 130 mm de hauteur et 75 mm de diamètre pour les femelles) rempli de tapis de reproduction. D) Les larves sont stockées dans une pièce à basse température.
le dimorphisme sexuel des cornes apparaît pour la première fois dans les primordiums des cornes au stade prépupal (Fig.3, Prénymphe)., L’un de mes principaux objectifs de recherche est de découvrir quels gènes contrôlent la formation des cornes, nous avons donc disséqué les primordiums des cornes chez les mâles et les femelles à ce stade et effectué une analyse comparative du transcriptome par ARN-seq. Nous avons effectué une comparaison intersexuée entre les ensembles de données du transcriptome primordial de la corne mâle et femelle, et avons essayé d’identifier les gènes responsables du développement de différentes morphologies entre le mâle et la femelle. En outre, nous avons également comparé les données du transcriptome entre différents types de cornes (cornes de tête et prothoraciques) intersexuellement chez les mâles et les femelles., En conséquence, nous avons identifié 1 553 gènes exprimés différentiellement (deg) au total. Pour identifier les gènes essentiels à la formation des cornes, nous nous sommes concentrés sur les gènes codant 38 facteurs de transcription et 11 molécules de signalisation incluses dans les 1 553 degrés, et avons effectué un criblage d’interférence ARN larvaire (Arni). Chez les coléoptères, y compris T. dichotomus, les expériences larvaires D’Arni sont extrêmement efficaces pour analyser la fonction des gènes pendant le développement postembryonique., L’ARN double brin (10-50 µg) a été injecté latéralement dans le segment T1 de chaque larve du dernier stade avant le stade prépupal à l’aide d’une seringue de 1 ml avec une aiguille de calibre 30. En conséquence, 11 gènes ont été nouvellement identifiés comme des gènes de formation de corne (Fig. 5A-E). Fait intéressant, ces 11 gènes sont principalement classés en tant que gènes de la tête et de l’appendice des larves.
Perspectives futures des études sur la corne des coléoptères
en plus des 11 gènes susmentionnés, nous avons identifié un certain nombre d’autres gènes de formation de la corne, mais le réseau de régulation des gènes pour la formation de la corne est encore inconnu., Jusqu’à présent, nous avons mis en place diverses ressources et outils nécessaires à la recherche sur la corne de coléoptère (stadification précise de la formation de la corne de coléoptère, Arni larvaire, hybridation in situ sur monture entière, immunomodulation, etc.). Par conséquent, il est devenu possible d’analyser le réseau de régulation des gènes de formation de corne par des approches biologiques développementales. De plus, nous allons tester si de nouveaux éléments de réglementation cis jouent un rôle crucial dans l’acquisition de cornes au cours de l’évolution., À cette fin, nous prévoyons de réaliser ATAC-seq (Assay for Transposase-Accessible Chromatin sequencing), une technique pour évaluer l’accessibilité de la chromatine à l’échelle du génome, dans le cadre d’un projet visant à estimer les éléments cis-régulateurs impliqués dans la formation et l’acquisition de corne. Grâce aux approches ci-dessus, nous pensons qu’une partie des mécanismes évolutifs associés à l’acquisition de la diversité animale sera démêlée au niveau moléculaire.
Si vous souhaitez plus d’informations sur les scarabées rhinocéros et les questions evo-devo sur les scarabées, veuillez me contacter ([email protected].,jp) ou Teruyuki Niimi ([email protected]).

 (+4 notation, 6 votes)
(+4 notation, 6 votes)
Partager
- Question:*
Votre Nom:* Votre Email:*
- Détails:*
Soumettre le Rapport
les Balises: une journée dans La vie, coléoptère, evo devo, organisme modèle
Catégories: Laboratoire de Vie