Come lo sapevano?
La geometria tetraedrica del carbonio era prevista già nel 1874. Ma come facevano a saperlo? Una domanda è venuta fuori guardando l’etano con un sostituente di bromo (C2H5Br). Quando si osservano le possibili strutture del composto C2H5Br ci sono diverse possibili formule strutturali.qui c’era un problema serio sul fatto che queste formule rappresentassero gli stessi composti o diversi., Tutto ciò che era noto nei primi giorni era che ogni campione purificato di C2H5Br, non importa quanto preparato, aveva un punto di ebollizione di 38 oC e una densità di 1.460 gml−1. Inoltre, tutti sembravano uguali, tutti avevano lo stesso odore e tutti subivano le stesse reazioni chimiche. Non c’era alcuna prova che C2H5Br fosse una miscela o che più di un composto di questa formula potesse essere preparato. Si potrebbe concludere, quindi, che tutte le formule strutturali di cui sopra rappresentano una singola sostanza, ma come? Una brillante soluzione al problema arrivò quando J. H., van’t Hoff ha proposto che tutti e quattro i legami di carbonio siano equivalenti e diretti agli angoli di un tetraedro regolare. Se ridisegniamo le strutture per C2H5Br con entrambi i carboni aventi geometria tetraedrica, vediamo che esiste solo una disposizione possibile. Questa teoria suggerisce l’idea della rotazione libera attorno ai legami sigma che saranno discussi in seguito.
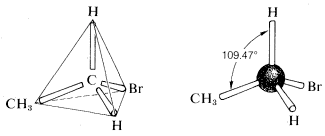
C’era un serio problema sul fatto che queste formule rappresentassero gli stessi composti o diversi., Tutto ciò che era noto nei primi giorni era che ogni campione purificato di C2H5Br, non importa quanto preparato, aveva un punto di ebollizione di 38 oC e una densità di 1.460 gml−1. Inoltre, tutti sembravano uguali, tutti avevano lo stesso odore e tutti subivano le stesse reazioni chimiche. Non c’era alcuna prova che C2H5Br fosse una miscela o che più di un composto di questa formula potesse essere preparato. Si potrebbe concludere, quindi, che tutte le formule strutturali di cui sopra rappresentano una singola sostanza, ma come? Una brillante soluzione al problema arrivò quando J. H., van’t Hoff ha proposto che tutti e quattro i legami di carbonio siano equivalenti e diretti agli angoli di un tetraedro regolare. Se ridisegniamo le strutture per C2H5Br con entrambi i carboni aventi geometria tetraedrica, vediamo che esiste solo una disposizione possibile. Questa teoria suggerisce l’idea della rotazione libera attorno ai legami sigma che saranno discussi in seguito.
