Guardando più da vicino: Acqua, il liquido più importante
La terra è l’unico corpo conosciuto nel nostro sistema solare che ha acqua liquida esistente liberamente sulla sua superficie. Questa è una buona cosa perché la vita sulla Terra non sarebbe possibile senza la presenza di acqua liquida.
L’acqua ha diverse proprietà che la rendono una sostanza unica tra le sostanze. È un eccellente solvente; scioglie molte altre sostanze e consente a tali sostanze di reagire quando sono in soluzione., Infatti, l’acqua è talvolta chiamata solvente universale a causa di questa capacità. L’acqua ha punti di fusione e ebollizione insolitamente elevati (0 ° C e 100 ° C, rispettivamente) per una molecola così piccola. I punti di ebollizione per molecole di dimensioni simili, come il metano (BP = -162°C) e l’ammoniaca (BP = -33°C), sono più bassi di 100°. Sebbene un liquido a temperature normali, le molecole d’acqua sperimentano un’interazione intermolecolare relativamente forte che consente loro di mantenere la fase liquida a temperature più elevate del previsto.,
A differenza della maggior parte delle sostanze, la forma solida dell’acqua è meno densa della sua forma liquida, che consente al ghiaccio di galleggiare sull’acqua. La configurazione più energeticamente favorevole delle molecole H2O è quella in cui ogni molecola è legata all’idrogeno a quattro molecole vicine. A causa dei moti termici, questo ideale non viene mai raggiunto nel liquido, ma quando l’acqua si congela nel ghiaccio, le molecole si depositano esattamente in questo tipo di disposizione nel cristallo di ghiaccio., Questa disposizione richiede che le molecole siano un po ‘ più distanti di quanto sarebbe altrimenti il caso; di conseguenza, il ghiaccio, in cui il legame con l’idrogeno è al massimo, ha una struttura più aperta e quindi una densità inferiore rispetto all’acqua.,
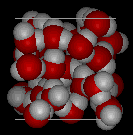
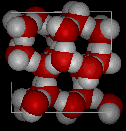
Ecco le viste tridimensionali di una tipica struttura locale di acqua (a sinistra) e ghiaccio (a destra.) Si noti la maggiore apertura della struttura del ghiaccio che è necessaria per garantire il più forte grado di legame dell’idrogeno in un reticolo cristallino uniforme ed esteso. La struttura dell’acqua liquida è molto simile, ma nel liquido, i legami idrogeno sono continuamente rotti e formati a causa del rapido movimento molecolare. Poiché il ghiaccio è meno denso dell’acqua liquida, fiumi, laghi e oceani si congelano dall’alto verso il basso., Infatti, il ghiaccio forma uno strato superficiale protettivo che isola il resto dell’acqua, permettendo ai pesci e ad altri organismi di sopravvivere nei livelli più bassi di un lago o di un mare ghiacciato. Se il ghiaccio fosse più denso del liquido, il ghiaccio formato in superficie con tempo freddo affonderebbe velocemente come si è formato. I corpi d’acqua si congelerebbero dal basso verso l’alto, il che sarebbe letale per la maggior parte delle creature acquatiche. L’espansione dell’acqua durante il congelamento spiega anche perché i motori di automobili o barche devono essere protetti da “antigelo” e perché i tubi non protetti nelle case si rompono se sono autorizzati a congelare.,
L’acqua richiede anche una quantità insolitamente grande di energia per cambiare la temperatura. Mentre 100 J di energia cambierà la temperatura di 1 g di Fe di 230°C, questa stessa quantità di energia cambierà la temperatura di 1 g di H2O di soli 100°C. Pertanto, l’acqua cambia lentamente la sua temperatura quando il calore viene aggiunto o rimosso. Ciò ha un impatto importante sul tempo, poiché i sistemi di tempesta come gli uragani possono essere influenzati dalla quantità di calore che l’acqua dell’oceano può immagazzinare.
L’influenza dell’acqua sul mondo che ci circonda è influenzata da queste proprietà., Non è affascinante che una molecola così piccola possa avere un impatto così grande?