Risultati di Apprendimento
- Derivare il predetto terra-stato configurazioni di elettroni di atomi
- Identificare e spiegare le eccezioni previste configurazioni di elettroni di atomi e ioni
- si Riferiscono elettrone configurazioni elemento classificazioni nella tavola periodica
Dopo aver introdotto le nozioni di base della struttura atomica e la meccanica quantistica, possiamo usare la nostra comprensione di numeri quantici per determinare la modalità di orbitali atomici si riferiscono l’uno all’altro., Questo ci permette di determinare quali orbitali sono occupati da elettroni in ogni atomo. La disposizione specifica degli elettroni negli orbitali di un atomo determina molte delle proprietà chimiche di quell’atomo.
Energie orbitali e struttura atomica
L’energia degli orbitali atomici aumenta all’aumentare del numero quantico principale, n., In ogni atomo con due o più elettroni, la repulsione tra gli elettroni rende energie di subshells con diversi valori di l diversi in modo che l’energia degli orbitali aumenta all’interno di un guscio in ordine di s < p < d < f. La figura 1 mostra come queste due tendenze in aumento di energia si riferiscono. L’orbitale 1s nella parte inferiore del diagramma è l’orbitale con elettroni di energia più bassa., L’energia aumenta man mano che ci spostiamo fino agli orbitali 2s e poi 2p, 3s e 3p, mostrando che il valore n crescente ha più influenza sull’energia rispetto al valore l crescente per i piccoli atomi. Tuttavia, questo modello non regge per atomi più grandi. L’orbitale 3d è più alto in energia rispetto all’orbitale 4s. Tali sovrapposizioni continuano a verificarsi frequentemente mentre ci spostiamo sul grafico.

Figura 1. Diagramma generalizzato del livello di energia per orbitali atomici in un atomo con due o più elettroni (non in scala).,
Gli elettroni in atomi successivi sulla tavola periodica tendono a riempire prima gli orbitali a bassa energia. Pertanto, molti studenti trovano confuso il fatto che, ad esempio, gli orbitali 5p si riempiono immediatamente dopo il 4d e immediatamente prima del 6s. L’ordine di riempimento si basa sui risultati sperimentali osservati ed è stato confermato da calcoli teorici. Man mano che il numero quantico principale, n, aumenta, la dimensione dell’orbitale aumenta e gli elettroni trascorrono più tempo più lontano dal nucleo., Pertanto, l’attrazione verso il nucleo è più debole e l’energia associata all’orbitale è più alta (meno stabilizzata). Ma questo non è l’unico effetto che dobbiamo prendere in considerazione. All’interno di ogni shell, all’aumentare del valore di l, gli elettroni sono meno penetranti (il che significa che c’è meno densità elettronica trovata vicino al nucleo), nell’ordine s> p> d> f., Gli elettroni che sono più vicini al nucleo respingono leggermente gli elettroni che sono più lontani, compensando leggermente le attrazioni elettrone–nucleo più dominanti (ricordiamo che tutti gli elettroni hanno cariche -1, ma i nuclei hanno cariche +Z). Questo fenomeno è chiamato schermatura e sarà discusso più dettagliatamente nella prossima sezione. Gli elettroni negli orbitali che sperimentano una maggiore schermatura sono meno stabilizzati e quindi più alti in energia., Per orbitali piccoli (da 1s a 3p), l’aumento di energia dovuto a n è più significativo dell’aumento dovuto a l; tuttavia, per orbitali più grandi le due tendenze sono comparabili e non possono essere semplicemente previste. Discuteremo i metodi per ricordare l’ordine osservato.
La disposizione degli elettroni negli orbitali di un atomo è chiamata configurazione elettronica dell’atomo., Descriviamo una configurazione elettronica con un simbolo che contiene tre informazioni (Figura 2):
- Il numero della shell quantistica principale, n,
- La lettera che designa il tipo orbitale (la subshell, l) e
- Un numero in apice che designa il numero di elettroni in quella particolare subshell.
Ad esempio, la notazione 2p4 (leggi “two–p–four”) indica quattro elettroni in una subshell p (l = 1) con un numero quantico principale (n) di 2. La notazione 3d8 (leggi “tre–d–otto”) indica otto elettroni nella subshell d (cioè,, l = 2) della shell principale per cui n = 3.
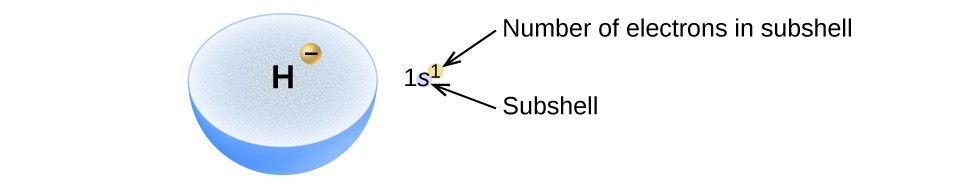
Figura 2. Il diagramma di una configurazione elettronica specifica la subshell (valore n e l, con il simbolo della lettera) e il numero in apice di elettroni.
Il principio Aufbau
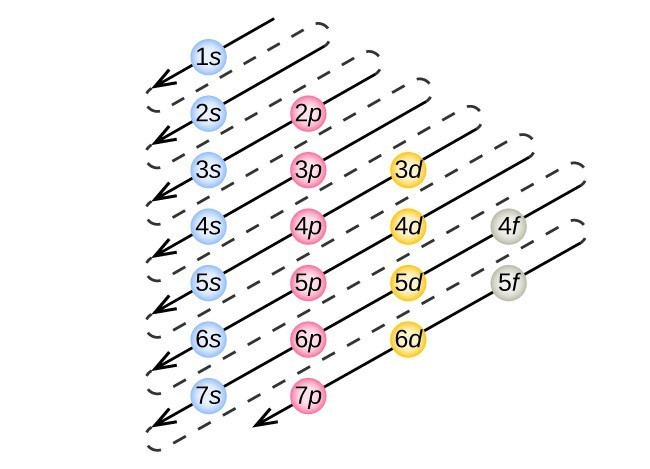
Figura 3. La freccia conduce attraverso ogni subshell nell’ordine di riempimento appropriato per le configurazioni di elettroni. Questo grafico è semplice da costruire. Basta creare una colonna per tutti gli orbitali s con ogni shell n su una riga separata., Ripeti per p, d e f. Assicurati di includere solo gli orbitali consentiti dai numeri quantici (no 1p o 2d e così via). Infine, disegna linee diagonali dall’alto verso il basso come mostrato.
Per determinare la configurazione elettronica per un particolare atomo, possiamo “costruire” le strutture nell’ordine dei numeri atomici. Iniziando con l’idrogeno, e continuando attraverso i periodi della tavola periodica, aggiungiamo un protone alla volta al nucleo e un elettrone alla subshell corretta fino a quando non abbiamo descritto le configurazioni di elettroni di tutti gli elementi.,
Questa procedura è chiamata principio Aufbau, dalla parola tedesca Aufbau (“costruire”). Ogni elettrone aggiunto occupa la subshell di energia più bassa disponibile (nell’ordine mostrato in Figura 1), fatte salve le limitazioni imposte dai numeri quantici consentiti secondo il principio di esclusione di Pauli. Gli elettroni entrano in subshell di energia superiore solo dopo che subshell di energia inferiore sono stati riempiti alla capacità. La figura 3 illustra il modo tradizionale di ricordare l’ordine di riempimento per gli orbitali atomici., Poiché la disposizione della tavola periodica si basa sulle configurazioni degli elettroni, la Figura 4 fornisce un metodo alternativo per determinare la configurazione degli elettroni. L’ordine di riempimento inizia semplicemente a idrogeno e include ogni subshell mentre si procede in ordine Z crescente. Ad esempio, dopo aver riempito il blocco 3p fino ad Ar, vediamo che l’orbitale sarà 4s (K, Ca), seguito dagli orbitali 3d.
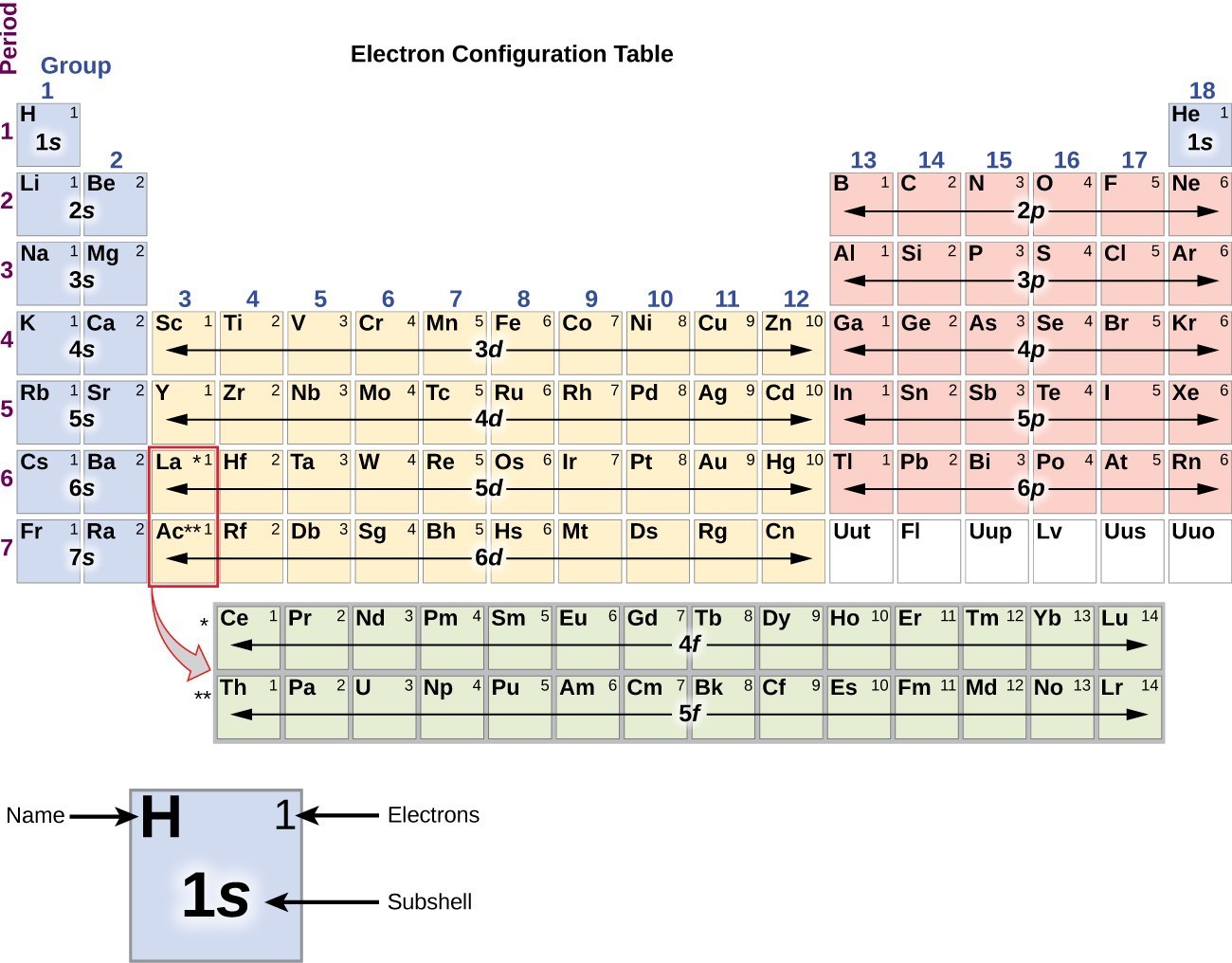
Figura 4. Questa tavola periodica mostra la configurazione elettronica per ogni subshell., “Accumulando” dall’idrogeno, questa tabella può essere utilizzata per determinare la configurazione elettronica per qualsiasi atomo sulla tavola periodica.
Costruiremo ora la configurazione elettronica dello stato fondamentale e il diagramma orbitale per una selezione di atomi nel primo e nel secondo periodo della tavola periodica. I diagrammi orbitali sono rappresentazioni pittoriche della configurazione elettronica, che mostrano i singoli orbitali e la disposizione di accoppiamento degli elettroni. Iniziamo con un singolo atomo di idrogeno (numero atomico 1), che consiste in un protone e un elettrone., Riferendosi alla Figura 3 o alla Figura 4, ci aspetteremmo di trovare l’elettrone nell’orbitale 1s. Per convenzione, il valore {m}_{s}=+\frac{1}{2} viene solitamente riempito per primo. La configurazione elettronica e il diagramma orbitale sono:

Dopo l’idrogeno è il gas nobile elio, che ha un numero atomico di 2. L’atomo di elio contiene due protoni e due elettroni. Il primo elettrone ha gli stessi quattro numeri quantici dell’atomo di idrogeno (n = 1, l = 0, ml=0, {m}_{s} = +\frac{1}{2} ). Il secondo elettrone entra anche nell’orbitale 1s e riempie quell’orbitale., Il secondo elettrone ha gli stessi numeri quantici n, l e ml, ma deve avere il numero quantico di spin opposto, {m} _ {s} = -\frac{1} {2}. Questo è in accordo con il principio di esclusione di Pauli: non ci sono due elettroni nello stesso atomo può avere lo stesso insieme di quattro numeri quantici. Per i diagrammi orbitali, questo significa che due frecce vanno in ogni casella (che rappresentano due elettroni in ogni orbitale) e le frecce devono puntare in direzioni opposte (che rappresentano gli spin accoppiati)., La configurazione elettronica e il diagramma orbitale dell’elio sono:
Il guscio n = 1 è completamente riempito in un atomo di elio.
L’atomo successivo è il litio metallo alcalino con un numero atomico di 3. I primi due elettroni nel litio riempiono l’orbitale 1s e hanno gli stessi insiemi di quattro numeri quantici dei due elettroni nell’elio. L’elettrone rimanente deve occupare l’orbitale dell’energia più bassa successiva, l’orbitale 2s (Figura 3 o Figura 4)., Pertanto, la configurazione elettronica e il diagramma orbitale del litio sono:

Un atomo del berillio metallico alcalino terroso, con un numero atomico di 4, contiene quattro protoni nel nucleo e quattro elettroni che circondano il nucleo. Il quarto elettrone riempie lo spazio rimanente nell’orbitale 2s.
Un atomo di boro (numero atomico 5) contiene cinque elettroni. Il guscio n = 1 è riempito con due elettroni e tre elettroni occuperanno il guscio n = 2., Poiché qualsiasi subshell s può contenere solo due elettroni, il quinto elettrone deve occupare il livello di energia successivo, che sarà un orbitale 2p. Ci sono tre orbitali degenerati 2p (ml = -1, 0, +1) e l’elettrone può occupare uno qualsiasi di questi orbitali P. Quando si disegnano diagrammi orbitali, includiamo scatole vuote per rappresentare eventuali orbitali vuoti nella stessa subshell che stiamo riempiendo.

Il carbonio (numero atomico 6) ha sei elettroni. Quattro di loro riempiono gli orbitali 1s e 2s. I restanti due elettroni occupano la subshell 2p., Ora abbiamo una scelta di riempire uno degli orbitali 2p e accoppiare gli elettroni o di lasciare gli elettroni spaiati in due orbitali p diversi, ma degenerati. Gli orbitali sono riempiti come descritto dalla regola di Hund: la configurazione di energia più bassa per un atomo con elettroni all’interno di un insieme di orbitali degenerati è quella con il numero massimo di elettroni spaiati. Pertanto, i due elettroni negli orbitali di carbonio 2p hanno numeri quantici identici n, l e ms e differiscono nel loro numero quantico ml (in accordo con il principio di esclusione di Pauli)., La configurazione elettronica e il diagramma orbitale per il carbonio sono:

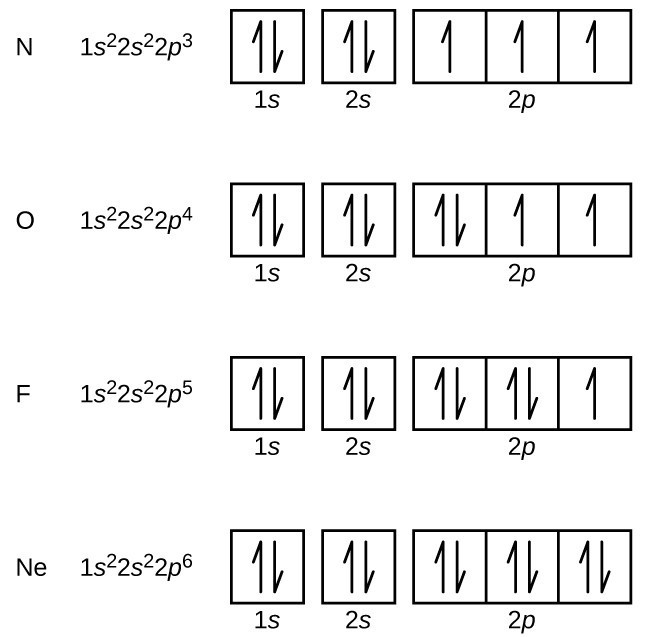
L’azoto (numero atomico 7) riempie le subshell 1s e 2s e ha un elettrone in ciascuno dei tre orbitali 2p, secondo la regola di Hund. Questi tre elettroni hanno spin spaiati. L’ossigeno (numero atomico 8) ha una coppia di elettroni in uno qualsiasi degli orbitali 2p (gli elettroni hanno spin opposti) e un singolo elettrone in ciascuno degli altri due. Il fluoro (numero atomico 9) ha solo un orbitale 2p contenente un elettrone spaiato., Tutti gli elettroni nel neon del gas nobile (numero atomico 10) sono accoppiati e tutti gli orbitali nei gusci n = 1 e n = 2 sono riempiti. Le configurazioni di elettroni e diagrammi orbitali di questi quattro elementi sono:
Il sodio del metallo alcalino (numero atomico 11) ha un elettrone in più rispetto all’atomo di neon. Questo elettrone deve entrare nella subshell di energia più bassa disponibile, l’orbitale 3s, dando una configurazione 1s22s22p63s1., Gli elettroni che occupano gli orbitali del guscio più esterno (il valore più alto di n) sono chiamati elettroni di valenza, e quelli che occupano gli orbitali del guscio interno sono chiamati elettroni del nucleo (Figura 5). Poiché i gusci di elettroni di nucleo corrispondono alle configurazioni di elettroni di gas nobile, possiamo abbreviare le configurazioni di elettroni scrivendo il gas nobile che corrisponde alla configurazione di elettroni di nucleo, insieme agli elettroni di valenza in un formato condensato. Per il nostro esempio di sodio, il simbolo rappresenta gli elettroni del nucleo (1s22s22p6) e la nostra configurazione abbreviata o condensata è 3s1.,

Figura 5. Una configurazione elettronica abbreviata in core (a destra) sostituisce gli elettroni core con il simbolo del gas nobile la cui configurazione corrisponde alla configurazione elettronica core dell’altro elemento.
Allo stesso modo, la configurazione abbreviata del litio può essere rappresentata come 2s1, dove rappresenta la configurazione dell’atomo di elio, che è identica a quella del guscio interno riempito di litio. La scrittura delle configurazioni in questo modo sottolinea la somiglianza delle configurazioni di litio e sodio., Entrambi gli atomi, che sono nella famiglia dei metalli alcalini, hanno un solo elettrone in una subshell di valenza s al di fuori di un insieme pieno di gusci interni.
\begin{array}{l}\text{Li:}\left2{s}^{1}\\ \text{Na:}\left3{s}^{1}\end{array}
Il magnesio metallico alcalino terroso (numero atomico 12), con i suoi 12 elettroni in una configurazione 3s2, è analogo al berillio membro della sua famiglia, 2s2. Entrambi gli atomi hanno una subshell s piena al di fuori dei loro gusci interni pieni., L’alluminio (numero atomico 13), con 13 elettroni e la configurazione elettronica 3s23p1, è analogo al suo boro membro della famiglia, 2s22p1.
L’elettrone configurazioni di silicio (14 elettroni), fosforo (15 elettroni), zolfo (16 elettroni), il cloro (17 elettroni) e argon (18 elettroni) sono analoghe a l’elettrone configurazioni di loro guscio esterno alla loro corrispondenza con i membri della famiglia di carbonio, azoto, ossigeno, fluoro, e al neon, rispettivamente, ad eccezione che il numero quantico principale dell’involucro esterno degli elementi più pesanti è aumentato da uno a n = 3., La figura 6 mostra la configurazione elettronica più bassa di energia, o stato fondamentale, per questi elementi e quella per gli atomi di ciascuno degli elementi noti.

Figura 6. Questa versione della tavola periodica mostra la configurazione elettronica del guscio esterno di ciascun elemento. Si noti che in ogni gruppo, la configurazione è spesso simile.
Quando arriviamo al prossimo elemento della tavola periodica, il potassio del metallo alcalino (numero atomico 19), potremmo aspettarci che inizieremmo ad aggiungere elettroni alla subshell 3d., Tuttavia, tutte le prove chimiche e fisiche disponibili indicano che il potassio è come il litio e il sodio e che l’elettrone successivo non viene aggiunto al livello 3d ma viene, invece, aggiunto al livello 4s (Figura 6). Come discusso in precedenza, l’orbitale 3d senza nodi radiali è più alto in energia perché è meno penetrante e più schermato dal nucleo rispetto al 4s, che ha tre nodi radiali. Pertanto, il potassio ha una configurazione elettronica di 4s1. Quindi, il potassio corrisponde a Li e Na nella sua configurazione di shell di valenza., L’elettrone successivo viene aggiunto per completare la subshell 4s e il calcio ha una configurazione elettronica di 4s2. Ciò dà al calcio una configurazione elettronica del guscio esterno corrispondente a quella del berillio e del magnesio.
A partire dal metallo di transizione scandio (numero atomico 21), ulteriori elettroni vengono aggiunti successivamente alla subshell 3d. Questa subshell è riempita alla sua capacità con 10 elettroni (ricorda che per l = 2 , ci sono 2l + 1 = 5 valori di ml, il che significa che ci sono cinque orbitali d che hanno una capacità combinata di 10 elettroni). La subshell 4p riempie successivo., Si noti che per tre serie di elementi, scandio (Sc) attraverso il rame (Cu), ittrio (Y) attraverso l’argento (Ag) e lutezio (Lu) attraverso l’oro (Au), un totale di 10 elettroni d vengono successivamente aggiunti al guscio (n – 1) accanto al guscio n per portare quel guscio (n – 1) da 8 a 18 elettroni. Per due serie, lantanio (La) attraverso lutezio (Lu) e attinio (Ac) attraverso lawrencio (Lr), 14 elettroni f (l = 3, 2l + 1 = 7 valori ml; così, sette orbitali con una capacità combinata di 14 elettroni) vengono successivamente aggiunti al guscio (n – 2) per portare quel guscio da 18 elettroni a un totale di 32 elettroni.,
Esempio 1: Numeri quantici e configurazioni di elettroni
Qual è la configurazione elettronica e il diagramma orbitale per un atomo di fosforo? Quali sono i quattro numeri quantici per l’ultimo elettrone aggiunto?
Controlla il tuo apprendimento
Identifica gli atomi dalle configurazioni di elettroni date:
- 4s23d5
- 5s24d105p6.
La tavola periodica può essere un potente strumento per predire la configurazione elettronica di un elemento. Tuttavia, troviamo eccezioni all’ordine di riempimento degli orbitali che sono mostrati in Figura 3 o Figura 4., Ad esempio, le configurazioni di elettroni (mostrate in Figura 6) dei metalli di transizione cromo (Cr; numero atomico 24) e rame (Cu; numero atomico 29), tra gli altri, non sono quelle che ci aspetteremmo. In generale, tali eccezioni coinvolgono subshell con energia molto simile e piccoli effetti possono portare a cambiamenti nell’ordine di riempimento.
Nel caso di Cr e Cu, troviamo che le subshell semi-riempite e completamente riempite apparentemente rappresentano condizioni di stabilità preferita., Questa stabilità è tale che un elettrone si sposta dal 4s all’orbitale 3d per ottenere la stabilità extra di una subshell 3d semi-riempita (in Cr) o una subshell 3d riempita (in Cu). Si verificano anche altre eccezioni. Ad esempio, si prevede che il niobio (Nb, numero atomico 41) abbia la configurazione elettronica 5s24d3. Sperimentalmente, osserviamo che la sua configurazione elettronica di stato fondamentale è in realtà 5s14d4., Possiamo razionalizzare questa osservazione dicendo che le repulsioni elettrone–elettrone sperimentate accoppiando gli elettroni nell’orbitale 5s sono più grandi del divario di energia tra gli orbitali 5s e 4d. Non esiste un metodo semplice per prevedere le eccezioni per gli atomi in cui la grandezza delle repulsioni tra elettroni è maggiore delle piccole differenze di energia tra subshell.,
Configurazioni elettroniche e Tavola periodica
Come descritto in precedenza, la tavola periodica organizza gli atomi in base all’aumento del numero atomico in modo che gli elementi con le stesse proprietà chimiche ricorrano periodicamente. Quando le loro configurazioni di elettroni vengono aggiunte alla tabella (Figura 6), vediamo anche una ricorrenza periodica di configurazioni di elettroni simili nei gusci esterni di questi elementi. Poiché si trovano nei gusci esterni di un atomo, gli elettroni di valenza svolgono il ruolo più importante nelle reazioni chimiche., Gli elettroni esterni hanno la più alta energia degli elettroni in un atomo e sono più facilmente persi o condivisi rispetto agli elettroni del nucleo. Gli elettroni di valenza sono anche il fattore determinante in alcune proprietà fisiche degli elementi.
Elementi in qualsiasi gruppo (o colonna) hanno lo stesso numero di elettroni di valenza; i metalli alcalini litio e sodio hanno ciascuno un solo elettrone di valenza, i metalli alcalino terrosi berillio e magnesio ne hanno ciascuno due, e gli alogeni fluoro e cloro hanno ciascuno sette elettroni di valenza., La somiglianza nelle proprietà chimiche tra elementi dello stesso gruppo si verifica perché hanno lo stesso numero di elettroni di valenza. È la perdita, il guadagno o la condivisione di elettroni di valenza che definisce come reagiscono gli elementi.
È importante ricordare che la tavola periodica è stata sviluppata sulla base del comportamento chimico degli elementi, ben prima che fosse disponibile qualsiasi idea della loro struttura atomica. Ora possiamo capire perché la tavola periodica ha la disposizione che ha-la disposizione mette elementi i cui atomi hanno lo stesso numero di elettroni di valenza nello stesso gruppo., Questa disposizione è enfatizzata nella Figura 6, che mostra in forma di tavola periodica la configurazione elettronica dell’ultima subshell da riempire dal principio Aufbau. Le sezioni colorate della Figura 6 mostrano le tre categorie di elementi classificati dagli orbitali che vengono riempiti: gruppo principale, transizione e elementi di transizione interni. Queste classificazioni determinano quali orbitali sono contati nel guscio di valenza, o più alto livello di energia orbitali di un atomo.,
- Gli elementi del gruppo principale (a volte chiamati elementi rappresentativi) sono quelli in cui l’ultimo elettrone aggiunto entra in un orbitale s o p nel guscio più esterno, mostrato in blu e rosso in Figura 6. Questa categoria comprende tutti gli elementi non metallici, così come molti metalli e gli elementi semimetallici intermedi. Gli elettroni di valenza per gli elementi del gruppo principale sono quelli con il più alto livello N. Ad esempio, il gallio (Ga, numero atomico 31) ha la configurazione elettronica 4s23d104p1, che contiene tre elettroni di valenza (sottolineati)., Gli orbitali d completamente riempiti contano come elettroni core, non di valenza.
- Elementi di transizione o metalli di transizione. Questi sono elementi metallici in cui l’ultimo elettrone aggiunto entra in un orbitale D. Gli elettroni di valenza (quelli aggiunti dopo l’ultima configurazione del gas nobile) in questi elementi includono gli elettroni ns e (n – 1) D. La definizione ufficiale IUPAC degli elementi di transizione specifica quelli con orbitali d parzialmente riempiti. Pertanto, gli elementi con orbitali completamente riempiti (Zn, Cd, Hg, così come Cu, Ag e Au in Figura 6) non sono tecnicamente elementi di transizione., Tuttavia, il termine è spesso usato per riferirsi all’intero blocco d (di colore giallo in Figura 6), e adotteremo questo uso in questo libro di testo.
- Gli elementi di transizione interni sono elementi metallici in cui l’ultimo elettrone aggiunto occupa un orbitale F. Sono mostrati in verde nella Figura 6. I gusci di valenza degli elementi di transizione interni sono costituiti da (n – 2)f, (n – 1)d e dalle subshell ns., Ci sono due interiore serie di transizione:
- I lantanidi serie: lantanidi (La) attraverso lutetium (Lu)
- Il attinidi serie: attinidi (Ac) attraverso lawrencium (Lr)
il Lantanio e il attinio, a causa delle loro somiglianze con gli altri membri della serie, sono compresi e utilizzati per il nome della serie, anche se sono metalli di transizione con n f elettroni.
Configurazioni elettroniche di ioni
Abbiamo visto che gli ioni si formano quando gli atomi guadagnano o perdono elettroni., Un catione (ion caricato positivamente) si forma quando uno o più elettroni vengono rimossi da un atomo genitore. Per gli elementi del gruppo principale, gli elettroni che sono stati aggiunti per ultimi sono i primi elettroni rimossi. Per i metalli di transizione e i metalli di transizione interni, tuttavia, gli elettroni nell’orbitale s sono più facili da rimuovere rispetto agli elettroni d o f, e quindi gli elettroni ns più alti vengono persi, e quindi gli elettroni (n – 1)d o (n – 2)f vengono rimossi. Un anione (ion caricato negativamente) si forma quando uno o più elettroni vengono aggiunti a un atomo genitore. Gli elettroni aggiunti riempiono l’ordine previsto dal principio di Aufbau.,
Esempio 2: la Previsione di Elettroni Configurazioni di Ioni
Qual è la configurazione elettronica orbitale e diagramma di:
- Na+
- P3–
- Al2+
- Fe2+
- Sm3+
Controlla il tuo apprendimento
Quale ion con una carica +2 ha la configurazione elettronica 1s22s22p63s23p63d104s24p64d5? Quale ion con una carica + 3 ha questa configurazione?
Concetti chiave e riepilogo
L’energia relativa delle sottocellule determina l’ordine in cui vengono riempiti gli orbitali atomici (1s, 2s, 2p, 3s, 3 p, 4 s, 3d, 4 p, e così via)., Le configurazioni di elettroni e i diagrammi orbitali possono essere determinati applicando il principio di esclusione di Pauli (non ci sono due elettroni possono avere lo stesso insieme di quattro numeri quantici) e la regola di Hund (quando possibile, gli elettroni mantengono spin spaiati negli orbitali degenerati).
Gli elettroni negli orbitali più esterni, chiamati elettroni di valenza, sono responsabili della maggior parte del comportamento chimico degli elementi. Nella tavola periodica, elementi con configurazioni di elettroni di valenza analoghi di solito si verificano all’interno dello stesso gruppo., Ci sono alcune eccezioni all’ordine di riempimento previsto, in particolare quando si possono formare orbitali semi-riempiti o completamente riempiti. La tavola periodica può essere divisa in tre categorie in base all’orbitale in cui è collocato l’ultimo elettrone da aggiungere: elementi di gruppo principali (orbitali s e p), elementi di transizione (orbitali d) e elementi di transizione interni (orbitali f).
Provalo
- Leggi le etichette di diversi prodotti commerciali e identifica gli ioni monatomici di almeno quattro elementi di transizione contenuti nei prodotti., Scrivi le configurazioni elettroniche complete di questi cationi.
- Leggere le etichette di diversi prodotti commerciali e identificare gli ioni monatomici di almeno sei elementi del gruppo principale contenuti nei prodotti. Scrivi le configurazioni elettroniche complete di questi cationi e anioni.,
- Utilizzo completo della subshell notazione (non abbreviazioni, 1s22s22p6, e così via), prevedere la configurazione elettronica di ciascuno dei seguenti atomi:
- C
- P
- V
- Sb
- Sm
- Utilizzo completo della subshell notazione (1s22s22p6, e così via), prevedere la configurazione elettronica di ciascuno dei seguenti atomi:
- N
- Si
- Fe
- Te
- Tb
- È 1s22s22p6 il simbolo di una proprietà macroscopiche o microscopiche proprietà di un elemento? Spiega la tua risposta.,
- Di quali informazioni aggiuntive abbiamo bisogno per rispondere alla domanda “Quale ion ha la configurazione elettronica 1s22s22p63s23p6”?,
- Disegnare il orbitale schema di valence shell di ciascuno dei seguenti atomi:
- C
- P
- V
- Sb
- Ru
- Utilizzare un orbitale schema per descrivere la configurazione elettronica di valenza shell di ciascuno dei seguenti atomi:
- N
- Si
- Fe
- Te
- Mo
- Utilizzo completo della subshell notazione (1s22s22p6, e così via), prevedere l’elettrone configurazioni dei seguenti ioni.,
- N3–
- Ca2+
- S–
- Cs2+
- Cr2+
- Gd3+
- Quale atomo ha la configurazione elettronica 1s22s22p63s23p64s23d104p65s24d2?
- Quale atomo ha la configurazione elettronica 1s22s22p63s23p63d74s2?
- Quale ion con una carica +1 ha la configurazione elettronica 1s22s22p63s23p63d104s24p6? Quale ion con una carica -2 ha questa configurazione?
- Quale dei seguenti atomi contiene solo tre elettroni di valenza: Li, B, N, F, Ne?
- Quale dei seguenti ha due elettroni spaiati?,
- Mg
- Si
- S
- Sia Mg che S
- Sia Si che S.
- Quale atomo dovrebbe avere una subshell 6p semi-riempita?
- Quale atomo dovrebbe avere una subshell 4s semi-riempita?
- In una zona dell’Australia, il bestiame non prosperava nonostante la presenza di foraggio adatto. Un’indagine ha mostrato che la causa è l’assenza di cobalto sufficiente nel terreno. Il cobalto forma cationi in due stati di ossidazione, Co2 + e Co3+. Scrivi la struttura elettronica dei due cationi.,
- Il tallio è stato usato come veleno nella storia misteriosa di Agatha Christie “Il cavallo pallido.”Il tallio ha due possibili forme cationiche ,+ 1 e + 3. I composti + 1 sono i più stabili. Scrivi la struttura dell’elettrone del catione + 1 del tallio.
- Scrivere l’elettrone configurazioni per i seguenti atomi o ioni:
- B3+
- O–
- Cl3+
- Ca2+
- Ti
- Cobalto–60 e iodio–131 sono isotopi radioattivi comunemente utilizzato in medicina nucleare. Quanti protoni, neutroni ed elettroni sono in atomi di questi isotopi?, Write the complete electron configuration for each isotope.
- Write a set of quantum numbers for each of the electrons with an n of 3 in a Sc atom.





