Introduzione
La cuticola vegetale è lo strato più esterno delle piante, che copre foglie, frutti, fiori e steli non legnosi delle piante superiori. Protegge le piante da siccità, temperature estreme, radiazioni UV, attacchi chimici, lesioni meccaniche e infezioni da agenti patogeni/parassiti. Fornisce anche supporto meccanico e funge da barriera contro la fusione di organi (Yeats e Rose, 2013; Kim et al., 2017).,
La cuticola vegetale comprende principalmente una matrice di cutina (un poliestere insolubile) e cera incorporata (lipidi solubili) (Figura 1) (Kunst e Samuels, 2009). Le composizioni di cera e cutina della cuticola vegetale possono variare ampiamente tra specie vegetali e vari organi (Yeats e Rose, 2013). La cuticola di ciascun organo ha caratteristiche specifiche, ad esempio, la cuticola della frutta è generalmente più spessa della cuticola fogliare e manca di stomi. Perché la cuticola della frutta è un modulatore critico della qualità della frutta post-raccolta, come i suoi effetti sulla ritenzione idrica della frutta (Kosma et al.,, 2010), responses to physical and biological stresss (Kosma et al., 2009), e fermezza (Matas et al., 2009; Lara et al., 2014; Vallarino et al., 2017), sta attirando l’attenzione crescente della ricerca.
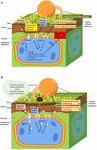
FIGURA 1. Modello ipotetico che rappresenta il coinvolgimento della cuticola vegetale durante le interazioni della pianta con vari agenti patogeni. (Un). Durante l’infezione patogena di piante resistenti, le proprietà specifiche della cuticola possono influenzare l’esito dell’interazione., Ad esempio, in risposta all’infezione, le piante con una cuticola più permeabile potrebbero rilasciare segnali di difesa molto più velocemente. Questi segnali comprendono alcuni monomeri cutinici o componenti di cera (ad esempio, smorzatori), suscitati da enzimi degradanti della cuticola o/e della parete cellulare secreti dai patogeni. Le piante con una cuticola più permeabile potrebbero anche rispondere più velocemente agli elicitori patogeni (ad esempio, MAMPs/PAMPs) e agli effettori nell’attivare la resistenza alle malattie delle piante attraverso PTI ed ETI, rispettivamente., Sia PTI che ETI attivano la resistenza alle malattie delle piante, ma ETI è una risposta più forte e più efficiente attraverso le interazioni delle proteine R con gli effettori patogeni. La risposta ETI potrebbe includere il rimodellamento della cuticola e della parete cellulare, il rilascio di composti antimicrobici e ROS e la produzione di ormoni di difesa, proteine PR e molecole di segnalazione SAR. (B)., Durante l’infezione del patogeno sugli ospiti sensibili della pianta, il potenziamento delle proprietà specifiche della cuticola, quale permeabilità, potrebbe condurre ai livelli riduttori di determinati monomeri della cutina e / o componenti della cera che potrebbero reprimere la virulenza e la patogenicità dei patogeni e dei loro effettori. Questi monomeri cutinici specifici e / o componenti di cera potrebbero servire come segnali per attivare la difesa delle piante localmente e / o sistemicamente. La maggiore permeabilità della cuticola potrebbe anche disturbare gli elicitor (MAMPs/PAMPs) che potrebbero essere rilevati dai recettori delle piante per innescare la difesa., L’aumento del rilascio di acqua e composti nutritivi disciolti sulla superficie fogliare potrebbe migliorare l’idoneità del patogeno e sostenerne la crescita e la patogenicità, e facilitare l’ingresso dei patogeni attraverso la cuticola e/o la parete cellulare della pianta e l’iniezione dei loro effettori virulenti e patogeni. Tutti questi effetti comprometteranno la capacità delle piante di attivare i loro meccanismi di difesa e alla fine si tradurrà nella loro suscettibilità ai patogeni.,
Per la maggior parte delle specie vegetali, i polimeri cutinici contengono principalmente acidi grassi esterificati e ossigenati C16 e C18 (FAs), piccole quantità di glicerolo, fenil-propanoidi, ecc., (Heredia, 2003). Le cere cuticolari sono miscele complesse, che consistono principalmente di vari alcani primari e secondari, alcoli, aldeidi, chetoni ed esteri derivati da FAS a catena molto lunga (C20-C34) (Raffaele et al., 2009; Malinovsky et al., 2014). Pertanto, i FAS sono i principali precursori per la biosintesi sia della cutina che della cera, che si verificano principalmente nei cloroplasti vegetali., I FAS risultanti vengono esportati in reticolo endoplasmatico (ER), attraverso la membrana plasmatica e la parete cellulare delle cellule epidermiche e si depositano nella membrana cuticolare nascente, dove formano cutine, cere e suberine (poliesteri complessi) (Kunst e Samuels, 2009; Yeats e Rose, 2013).
Ci sono stati progressi significativi negli ultimi 20 anni sull’identificazione e la caratterizzazione dei geni coinvolti nella cutina vegetale e nella biosintesi delle cere (Suh et al., 2005; Lee e Suh, 2013; Fich et al., 2016)., Inoltre, fattori coinvolti nel trasporto di precursori di cutine e cere, come le proteine leganti l’acil-CoA (ACBPs) (Xia et al., 2012; Xue et al., 2014), lipid transfer protein (LTP) (Deeken et al., 2016), e ABC transporter (Luo et al., 2007), sono stati caratterizzati. Inoltre, diversi fattori di trascrizione, come AP2, MYB94, MYB96, MYB16 e zinco-dito NFXL2 sono stati trovati a svolgere un ruolo critico nella regolazione della biosintesi della cutina vegetale e cera (Fich et al., 2016; Lee et al., 2016)., Ci sono prove crescenti che la cuticola non è semplicemente uno strato fisico che protegge le piante; sembra essere attivamente coinvolta nella difesa delle piante e nelle vie di segnalazione per la crescita e lo sviluppo (Raffaele et al., 2009; Javelle et al., 2011; Aragón et al., 2017). Vari studi hanno dimostrato che la cuticola vegetale potrebbe funzionare nel primo strato di immunità innescata dal pattern di difesa delle piante e nel secondo, più forte strato di immunità innescata dall’effettore di difesa delle piante (ETI). Pertanto, serve ad attivare la resistenza acquisita locale e sistemica contro diversi agenti patogeni (Figura 1) (Heredia, 2003; Xia et al.,, 2009; Aragón et al., 2017). I geni vegetali e i fattori di trascrizione coinvolti nella biosintesi/segnalazione della cuticola e le interazioni pianta-microbo associate sono stati ben riassunti in diverse recensioni informative (Chassot e Métraux, 2005; Muller e Riederer, 2005; Reina-Pinto e Yephremov, 2009; Lee e Suh, 2013; Serrano et al., 2014; Fich et al., 2016; Aragón et al., 2017). Gli studi sulla comunità microbica vegetale associata alla superficie cuticolare sono stati ben recensiti da Aragón et al. (2017)., Questi studi, sebbene rilevanti, non saranno ulteriormente discussi in questa mini-recensione a causa della limitazione dello spazio.
Questa recensione riassume brevemente i ruoli multifunzionali della cuticola vegetale durante le interazioni pianta-patogeno, con enfasi su: cambiamenti dinamici della cuticola vegetale e la loro regolazione; il crosstalk della cuticola con la parete cellulare e diverse vie di segnalazione ormonale per la difesa delle piante; e principali meccanismi biochimici, molecolari e cellulari che sono alla base dei ruoli della cuticola, La presente recensione discute anche le sfide e le direzioni future per lo studio correlato, come i nuovi geni e meccanismi coinvolti nel trasporto, nella regolazione, nell’assemblaggio e nella deposizione di precursori/segnali cuticole e le interazioni pianta-patogeno associate.
La cuticola vegetale e la parete cellulare formano un Continuum sulla superficie della pianta, che è dinamico e reattivo a diverse infezioni patogene
La parete cellulare vegetale si estende tra la cuticola e la membrana cellulare dell’epidermide e forma un continuum con la cuticola (Figura 1; Nawrath et al., 2013)., I componenti principali della parete cellulare vegetale sono cellulosa, emicellulosa, pectina e lignina. Sono coinvolti nel mantenimento della forma cellulare, nel supporto della crescita e dello sviluppo delle piante e nella protezione delle piante dagli stress biotici e abiotici (Keegstra, 2010). Questi polisaccaridi della parete cellulare possono essere incorporati nella matrice cutina e quindi determinare l’elasticità e la rigidità dell’intera cuticola (Lopez-Casado et al., 2007). La cera cuticolare forma una barriera alla traspirazione (Schonherr, 1976) e la matrice cutinica contribuisce alla sua resistenza meccanica (Kolattukudy, 1980).,
Cuticola e parete cellulare svolgono ruoli sovrapposti nelle piante; oltre al loro ruolo di barriere fisiche e chimiche passive, funzionano attivamente insieme nella regolazione del movimento delle molecole dentro e fuori dalle piante. Svolgono anche ruoli critici nel trasmettere segnali all’interno e all’esterno delle cellule vegetali in risposta a diverse stimolazioni per la crescita e lo sviluppo delle piante e la resistenza agli stress biotici e abiotici (Segado et al., 2016)., Sia la parete cellulare che la cuticola possono espandersi e cambiare le loro composizioni durante varie fasi di crescita e sviluppo delle piante e in risposta a diverse condizioni ambientali (Bargel e Neinhuis, 2005; Underwood, 2012). Durante le interazioni pianta-agente patogeno, cuticola vegetale e composizioni parete cellulare potrebbero essere influenzati da agenti patogeni, e viceversa, agenti patogeni possono percepire componenti pianta-superficie e regolare la loro patogenesi e virulenza di conseguenza., In una fase iniziale dell’infezione, i funghi fitopatogeni possono sintetizzare enzimi idrolitici, come cutinasi, esterasi e lipasi, che mirano direttamente alla cuticola e quindi svolgono un ruolo chiave nell’infezione patogena (Berto et al., 1999; Garrido et al., 2012; Leroch et al., 2013; Wang et al., 2017). Ad esempio, il patogeno fungino Fusarium oxysporum secerne le cutinasi, che degradano la cuticola delle foglie delle piante e producono livelli basali di monomeri di cutina per facilitare l’adesione del patogeno agli ospiti in una fase iniziale dell’infezione., Una volta che un agente patogeno percepisce i monomeri cuticolari della pianta risultanti, può espandere la sua attività cutinasi per facilitare un’ulteriore penetrazione e infezione nello strato della cuticola della pianta (Woloshuk e Kolattukudy, 1986). I componenti della cutina delle foglie delle piante, come l’esadecandiolo nel riso, potrebbero indurre la germinazione e la differenziazione dell’appressorio del fungo di esplosione del riso Magnaporthe grisea (Gilbert et al., 1996) e spore germinazione e cutinasi espressione della muffa grigia fungo Botrytis cinerea (Leroch et al., 2013)., Inoltre, i componenti della cera vegetale, come le aldeidi C26 a catena molto lunga del mais (Zea mays) potrebbero influenzare la germinazione delle spore e la penetrazione dell’oidio d’orzo Blumeria graminis f.sp. hordei (Hansjakob et al., 2011). È interessante notare che molti funghi, come la Botrite (Castillo et al., 2017), Phytophthora (Blackman et al., 2014) e M. oryzaea (Quoc e Chau, 2017) secernono anche enzimi degradanti della parete cellulare (CAZymes) anche prima che penetrino nella cuticola, che è un’ulteriore prova che il continuum cuticola/parete cellulare è un fattore significativo nelle interazioni pianta-patogeno.,
Al contrario, le piante possono riconoscere l’attaccamento dei patogeni e reagire molto rapidamente agli elicitor (MAMPs / PAMPs) che producono. I DAMP, i prodotti di degradazione delle piante generati dall’infezione da agenti patogeni, come i monomeri della cutina e gli oligosaccaridi della parete cellulare, servono anche come segnali che attivano le difese delle piante contro i patogeni (Underwood, 2012; Malinovsky et al., 2014)., Ad esempio, la cuticola del frutto del pomodoro è stata rimodellata in risposta all’infezione dei patogeni fungini Colletotrichum gloeosporioides e la biosintesi della cuticola del frutto è stata regolata durante la formazione dell’appressorio anche prima della penetrazione (Alkan et al., 2015). Un altro esempio, durante l’infezione dei petali di agrumi da parte di Colletotrichum acutatum, le cellule epidermiche hanno risposto al patogeno aumentando la sintesi lipidica e la deposizione di composti associati alla cuticola e alla parete cellulare, e questo alla fine ha alterato le strutture della cuticola (Marques et al., 2016)., In Arabidopsis, invece della cuticola, le galle della corona causate dall’infezione del batterio Agrobacterium tumefaciens sono coperte di suberina, che ha bisogno del trasporto di FAs per sostenere la sua sintesi (Deeken et al., 2016).
Oltre alla cera e alla cutina, la cuticola vegetale contiene terpenoidi e flavonoidi, che hanno attività antifungine (Arif et al., 2009; Zacchino et al., 2017). La biosintesi di questi fenilpropanoidi e flavonoidi segue la formazione di lipidi cuticolari (Mintz-Oron et al., 2008), che potrebbe essere indotto in risposta a segnali ambientali, come C., infezione da gloeosporioides, attivando così le difese delle piante nei frutti di pomodoro e mango (Alkan et al., 2015; Sivankalyani et al., 2016).
Permeabilità della cuticola, composizione e ruoli multipli durante l’interazione pianta-agente patogeno
La cuticola vegetale svolge anche ruoli critici nella difesa delle piante contro diversi agenti patogeni batterici e fungini, la maggior parte dei quali utilizza aperture naturali, come stomi e idatodi nelle foglie o lenticelle nei frutti per entrare nelle piante senza penetrare direttamente, 2014)., L’integrità e la permeabilità della cuticola sono molto importanti per la sua funzione durante le interazioni pianta-agente patogeno; per esempio, una cuticola vegetale più permeabile potrebbe portare a resistenza o suscettibilità alle infezioni del patogeno.
Studi precedenti su mutanti cuticole difettosi di Arabidopsis e pomodoro, come CYP86A2 (ossidasi dipendenti dal citocromo P450) (Xiao et al., 2004), LACS2 (Acil-COA sintetasi a catena lunga) (Bessire et al., 2007; Tang et al., 2007), PER57 (perossidasi 57 sovraespressa) (Survila et al., 2016), GUARDIA DEL CORPO (alfa-beta idrolasi) (Céline et al.,, 2007), e DEWAX transcription factor (Suh e Go, 2014; Ju et al., 2017) hanno dimostrato di aumentare la permeabilità della cuticola fogliare. È interessante notare che questi mutanti hanno migliorato la resistenza delle piante contro il patogeno fungino B. cinerea ma hanno aumentato la suscettibilità al patogeno batterico Pseudomonas syringae. Tuttavia, non tutti i mutanti legati alla cuticola hanno mostrato resistenza a B., cinerea: ad esempio, il nostro precedente studio ha rilevato che i mutanti Arabidopsis ACP4 (acyl carrier protein 4) e GL1 (GLABROUS 1) avevano ridotto i livelli di cutina e componenti di cera, migliorato la permeabilità della cuticola fogliare e aumentato la suscettibilità a entrambi gli agenti patogeni (Xia et al., 2009, 2010). In altri studi, mutazioni nei fattori di trascrizione SHINE hanno provocato un’alterazione della cuticola, che ha portato alla suscettibilità delle piante all’infezione da B. cinerea (Sela et al., 2013; Buxdorf et al., 2014).
Diversi meccanismi possono spiegare la maggiore resistenza delle foglie a B., cinerea e altri agenti patogeni quando aumenta la permeabilità della cuticola vegetale:
(1) Rilascio di alcuni monomeri di cutina o componenti di cera che funzionano come segnali per attivare la resistenza alle malattie delle piante (Aragón et al., 2017);
(2) Rilascio di diffusori antifungini e ROS (specie reattive dell’ossigeno) che inibiscono la crescita e l’infezione del patogeno in superficie (L’Haridon et al., 2011; Sela et al., 2013);
(3) Assorbimento accelerato di elicitor (ad es.,, MAMPs/PAMPs/DAMPs) attivati da patogeni per PTI; e rilascio di effettori avirulenti per ETI, che potrebbero stimolare una risposta di difesa delle piante più forte e più efficiente (Chassot et al., 2008; Aragón et al., 2017).
Un modello ipotetico del relativo meccanismo di resistenza alle malattie delle piante è raffigurato nella Figura 1A.
Sono stati suggeriti diversi meccanismi con cui la permeabilità della cuticola fogliare potrebbe aumentare la suscettibilità delle piante a P., syringae e altri agenti patogeni:
(1) Riduzioni dei livelli di alcuni monomeri di cutina e / o componenti di cera che aiutano a reprimere l’espressione e la funzione degli effettori patogeni coinvolti nella virulenza e nella patogenicità, come Arabidopsis CYP86A2. Questo gene è coinvolto nella formazione di C16 e C18 idrossi FAs, che hanno impatti inibitori diretti contro alcuni agenti patogeni, come P. syringae (Xiao et al., 2017).,
(2) Riduzioni dei livelli di monomeri cutinici e/o componenti di cera che possono servire come segnali o recettori per attivare la difesa delle piante localmente e / o sistemicamente sia per PTI che per ETI; nel nostro precedente studio su Arabidopsis ACP4, le piante mutanti ACP4 hanno ridotto significativamente sia la biosintesi della cutina che della cera, causando difetti sia nell’immunità locale che sistemica delle piante contro P. syringae (Xia et al., 2009, 2010).,
(3) Compromissione della risposta di difesa delle piante da interruzione della percezione dei recettori vegetali degli elicitori generati dagli agenti patogeni (MAMPs/PAMPs) o attivazione sovra-stimolata di alcuni geni mediante produzione accelerata di ROS per causare suscettibilità e morte delle piante (Sela et al., 2013).
(4) Maggiore disponibilità di acqua e composti nutritivi disciolti sulla superficie fogliare, che migliorerebbero l’idoneità, la crescita e la patogenicità dei patogeni (Schreiber et al.,, 2005);
(5) Modifiche agli stomi e al continuum della parete cuticola-cellulare che forniscono un modo più semplice per i patogeni di entrare nelle piante e rilasciare i loro effettori di virulenza all’interno.
Il modello ipotetico per spiegare il meccanismo correlato nella suscettibilità alle malattie delle piante è illustrato nella Figura 1B.
Poiché B. cinerea è un agente patogeno necrotrofico e P. syringae è un agente patogeno emi-biotrofico, la cuticola può avere modalità di azione specifiche per interagire con agenti patogeni con stili di vita diversi., Le funzioni specifiche di vari componenti della cuticola della foglia della pianta possono svolgere diversi ruoli nelle interazioni pianta-patogeno; tuttavia, ciò richiede ulteriori indagini.
Il ruolo della cuticola della frutta nella protezione post-raccolta dai patogeni è stato ampiamente studiato. Recenti scoperte suggeriscono che la composizione della cuticola, piuttosto che il suo semplice spessore, determina la risposta della frutta agli agenti patogeni post-raccolta. Ad esempio, durante la maturazione dei frutti, la suscettibilità dei frutti di pomodoro all’infezione fungina necrotrofica è aumentata (Segado et al.,, 2016), mentre le bacche d’uva hanno acquisito resistenza all’oidio patogeno fungino biotrofico (Uncinula necator) man mano che crescevano e si sviluppavano (Fich et al., 2016). Pertanto, i molteplici ruoli della cuticola vegetale durante le interazioni pianta-patogeno possono essere influenzati dallo spessore della cuticola, dalla permeabilità o da specifici componenti cuticolari in diversi tessuti; variano anche con diverse fasi di crescita e condizioni ambientali.,
gli Ormoni sono Coinvolti nella Cuticola Formazione e relativa Segnalazione Durante le Interazioni Pianta-Patogeno
gli Ormoni regolano la crescita delle piante durante l’intero ciclo di vita, controllo della divisione cellulare, l’allungamento e la differenziazione dei tessuti modello di formazione e di sviluppo, e le risposte a stress biotici e abiotici (Robert-Seilaniantz et al., 2007). Sono stati fatti progressi significativi nello studio della biosintesi e della regolazione di vari ormoni, come l’acido salicilico (SA), l’acido jasmonico (JA), le gibberelline (GA), l’acido abscissico (ABA) e l’etilene (ET) (Kimbara et al.,, 2013; De Smet et al., 2015). E i ruoli critici di questi ormoni nelle interazioni pianta-microbo erano ben documentati (Denancé et al., 2013). È stato studiato anche lo studio della diafonia tra ormoni vegetali e cuticola per la sua biosintesi e le relative funzioni durante le condizioni di stress, come l’infezione da agenti patogeni, ma rimangono grandi lacune nelle nostre conoscenze.
Diversi ormoni vegetali hanno dimostrato di influenzare la formazione della cuticola vegetale e la tolleranza allo stress., Ad esempio, abbiamo scoperto che le piante Arabidopsis trattate con GA4 e GA7 mostravano livelli aumentati di cera cuticolare e componenti cutinici, che erano associati alla migliore immunità delle piante contro l’infezione batterica del patogeno P. syringae (Xia et al., 2010).
L’acido jasmonico, un ormone importante nella difesa delle piante, deriva dal 18: 3 FA (acido linolenico). Il trattamento con metil-JA delle piantine di Vicia sativa è stato trovato per indurre la produzione di ω-idrossi FAs, che sono stati coinvolti nella formazione di cutina (Pinot et al., 1998)., Inoltre, l’ω-idrossi FAs potrebbe indurre la resistenza delle piante contro l’infezione del patogeno funzionando come molecole di segnalazione endogene; ad esempio, potrebbero svolgere un ruolo critico nella resistenza dell’orzo contro il patogeno fungino Erysiphe graminis f.sp. hordei (Schweizer et al., 1996).
Il gene Arabidopsis RST1 (RESURRECTION1) funziona in modo importante sia nella biosintesi della cutina e della cera, sia nella difesa delle piante. Le piante mutanti rst1 hanno mostrato resistenza a B. cinerea associata ai livelli di espressione up-regulated di JA e al relativo gene di difesa PDF1.2., Tuttavia, le piante mutanti rst1 hanno mostrato livelli down-regolati di proteine SA e PR, come PR-1, che erano correlati con la loro suscettibilità al patogeno biotrofico, Erysiphe cichoracearum (Mang et al., 2009).
Le piante mutanti del fattore di trascrizione Arabidopsis SHN1 mostravano composizioni difettose della cuticola fogliare e una maggiore suscettibilità a B. cinerea. Le piante shn1-1D hanno accumulato alti livelli di H2O2 e hanno regolato un ampio insieme di geni associati alla senescenza, allo stress ossidativo e alla difesa (Sela et al., 2013)., Per esempio, i geni ROS-associati PROPEP3 (precursore del peptide 3 di elicitor) e AOX1d (gene alternativo dell’ossidasi) erano altamente up-regolati. Era stato previsto che PROPEP3 fosse l’amplificatore per i percorsi ET/JA e SA, e l’espressione di AOX1d era anche associata a questi percorsi (Lin e Wu, 2004; Huffaker e Ryan, 2007). La suscettibilità di B. cinerea delle piante shn1-1D potrebbe essere eccessivamente accelerata nella generazione di ROSs, come H2O2, portando a reazioni incontrollate e eccessive di difesa e conseguente sensibilità e morte delle piante (Sela et al., 2013).,
Inoltre, l’applicazione esogena di ABA può stimolare specificamente la formazione di componenti cuticolari in Arabidopsis, Lepidium sativum e piante di pomodoro, e questo ha contribuito a ridurre la perdita di acqua delle piante durante la siccità (Kosma et al., 2009; Macková et al., 2013; Cui et al., 2016; Martin et al., 2017). Inoltre, un mutante sitiens (sit) carente di pomodoro con ridotti livelli di ABA e maggiore permeabilità della cuticola mostrava una maggiore resistenza contro B. cinerea., La resistenza alle malattie correlata era associata non solo ai cambiamenti nella permeabilità della cuticola, ma anche ai cambiamenti nelle composizioni della parete cellulare. Ad esempio, dopo l’infezione del patogeno i livelli di metil-esterificazione della pectina e vari oligosaccaridi erano più alti nei mutanti che nelle piante di tipo selvatico (Curvers et al., 2010).
I meccanismi di diafonia tra cuticola e vie ormonali vegetali durante le interazioni dei patogeni con i frutti hanno iniziato a essere chiariti solo di recente., Infatti sia la segnalazione ABA che ET svolgono un ruolo importante nella regolazione della biosintesi e della funzione della cuticola della frutta (Alkan e Fortes, 2015; Leida et al., 2016; Wang et al., 2017).
Le possibilità che altri percorsi ormonali crosstalk con biosintesi cuticola e vie di segnalazione sono in gran parte sconosciuti. Le interazioni tra gli ormoni vegetali e la cuticola vegetale in relazione alla risposta alle infezioni patogene devono essere ulteriormente studiate.,
Conclusione e prospettive
Complessivamente, abbiamo brevemente riassunto i recenti progressi nella nostra conoscenza di molteplici ruoli della cuticola vegetale durante le interazioni con diversi agenti patogeni. La ricerca nei campi relativi ha prodotto la prova che la cuticola della pianta svolge i ruoli critici durante le interazioni pianta-agente patogeno. Tuttavia, siamo ancora lontani dalla piena comprensione dei meccanismi rilevanti e dallo sviluppo di strategie efficienti per utilizzare la cuticola vegetale per la difesa delle piante., Inoltre, studi di diversi aspetti rafforzeranno la nostra comprensione dei meccanismi correlati, che includono i ruoli specifici dei vari componenti della cutina e della cera come fattori importanti e molecole di segnalazione che promuovono la resistenza o la suscettibilità; trasmissione e percezione dei fattori e dei segnali correlati;e la diafonia tra la parete cuticola-cellulare e le vie di segnalazione ormonale, ecc., Studi di tutti questi ci forniranno conoscenze più dettagliate per sviluppare approcci di allevamento e biotecnologici per migliorare la funzione della cuticola e quindi migliorare la salute e la resa delle piante.
Contributi dell’autore
YX e CZ hanno organizzato e scritto l’intero manoscritto, Z e YG hanno contribuito a parte della scrittura e del miglioramento.,
Finanziamento
Questo progetto è stato supportato dal progetto Hatch da USDA-NIFA-OHO01392; l’Ohio Agricultural Research and Development Center (OARDC) seed grant OHOA1591& OHOA1615; fondo di avvio da OARDC e Ohio State University a YX.
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Ringraziamenti
Vorremmo ringraziare Yonatan Ziv per il suo aiuto con le figure.,
Schonherr, J. (1976). Permeabilità all’acqua delle membrane cuticolari isolate: effetto del pH e dei cationi sulla diffusione, permeabilità idrodinamica e dimensione dei pori polari nella matrice cutinica. Pianta 128, 113-126. doi: 10.1007/bf00390312
PubMed Abstract / CrossRef Full Text / Google Scholar