Fino ad ora, tutte le nostre reazioni hanno avuto luogo in condizioni ideali. Tuttavia, le condizioni ideali non esistono nella vita reale. I reagenti possono essere impuri, le reazioni potrebbero non andare a completamento o le reazioni date potrebbero dover competere con diverse reazioni collaterali più piccole. Infatti, in laboratorio, se si ottiene il 60% della quantità prevista di prodotto, che è considerato molto buono.
Ora, parliamo di terminologia. La quantità calcolata o prevista di prodotto è chiamata resa teorica., La quantità di prodotto effettivamente prodotta è chiamata resa effettiva. Quando si divide il rendimento effettivo per il rendimento teorico si ottiene una percentuale decimale nota come il rendimento percentuale di una reazione.
% Di Rendimento = 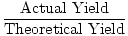 |
ancora una Volta è il momento per un problema di esempio:
Problema: Qual è la percentuale di rendimento della seguente reazione se il 60 grammi di CaCO3 è riscaldata per dare 15 grammi di CaO?,
| CaCO3→CaO + CO2 |
Soluzione: Idealmente, quanti grammi di CaO deve essere prodotta? Prima verifica che l’equazione sia bilanciata; lo è. Ora convertire in talpe, in base alla quantità di CaCO3 presente.
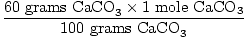 × ×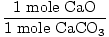 = 0.6 mole di CaO = 0.6 mole di CaO |
quanti grammi è?,
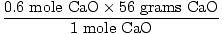 = 33.6 grammi CaO = 33.6 grammi CaO |
Così, idealmente, 33.6 g di CaO sono stati realizzati in questa reazione. Questa è la resa teorica. Tuttavia, il problema ci dice che sono stati prodotti solo 15 grammi. 15 grammi è la resa effettiva. Ora è una questione semplice trovare il rendimento percentuale.