Învățării
- determinarea prezis sol-stat configurațiile electronice ale atomilor
- Identifica și explica excepții de la prezis configurațiile electronice pentru atomii și ionii de
- se Referă configurații de electroni la elementul clasificări în tabelul periodic
Au introdus elementele de bază ale structurii atomice și a mecanicii cuantice, ne putem folosi de înțelegerea noastră de numere cuantice pentru a determina cum atomica orbitalii se referă la unul pe altul., Acest lucru ne permite să determinăm care orbite sunt ocupate de electroni în fiecare atom. Aranjamentul specific al electronilor în orbitalii unui atom determină multe dintre proprietățile chimice ale acelui atom.
energiile orbitale și structura atomică
energia orbitalilor atomici crește pe măsură ce numărul cuantic principal, n, crește., În orice atom cu doi sau mai mulți electroni, repulsia dintre electroni face energii de subshells cu diferite valori de l diferă, astfel încât energia orbitalilor crește într-o coajă în ordinea în care s < p < d < f. Figura 1 ilustrează modul în care aceste două tendințe în creștere de energie se referă. Orbitalul 1s din partea de jos a diagramei este orbitalul cu electroni cu cea mai mică energie., Energia crește pe măsură ce ne mișcăm până la orbitalii 2S și apoi 2P, 3s și 3p, arătând că valoarea N în creștere are mai multă influență asupra energiei decât valoarea l în creștere pentru atomii mici. Cu toate acestea, acest model nu este valabil pentru atomi mai mari. Orbitalul 3D este mai mare în energie decât orbitalul 4S. Astfel de suprapuneri continuă să apară frecvent pe măsură ce avansăm în grafic.

Figura 1. Diagrama generalizată a nivelului de energie pentru orbitalii atomici într-un atom cu doi sau mai mulți electroni (nu la scară).,
electronii din atomii succesivi din tabelul periodic tind să umple mai întâi orbitalii cu energie redusă. Astfel, mulți studenți se pare ciudat că, de exemplu, 5p orbitali umple imediat după 4d, și imediat înainte de 6s. Ordinea de umplere se bazează pe respectate rezultate experimentale, și a fost confirmat de calculele teoretice. Pe măsură ce numărul cuantic principal, N, crește, mărimea orbitalului crește și electronii petrec mai mult timp mai departe de nucleu., Astfel, atracția către nucleu este mai slabă, iar energia asociată orbitalului este mai mare (mai puțin stabilizată). Dar acesta nu este singurul efect pe care trebuie să-l luăm în considerare. În fiecare coajă, ca valoare de l crește, electronii sunt mai puțin penetrante (sensul nu este mai mică densitate de electroni găsit aproape de nucleu), în ordinea în care s > p > d > f., Electronii care sunt mai aproape de nucleu ușor respinge electronii care sunt mai departe, compensând mai dominant electron–nucleu atracții ușor (reamintim că toți electronii au -1 taxe, dar nuclee au +Z taxe). Acest fenomen se numește ecranare și va fi discutat mai detaliat în secțiunea următoare. Electronii din orbitali care prezintă mai multă ecranare sunt mai puțin stabilizați și astfel mai mari în energie., Pentru orbitalii mici (1s până la 3p), creșterea energiei datorată lui n este mai semnificativă decât creșterea datorată lui l; cu toate acestea, pentru orbitalii mai mari, cele două tendințe sunt comparabile și nu pot fi pur și simplu prezise. Vom discuta despre metodele de amintire a ordinii observate.aranjamentul electronilor în orbitalii unui atom se numește configurația electronică a atomului., Vom descrie o configurație electronică cu un simbol care conține trei bucăți de informații (Figura 2):
- numărul cuantic principal shell, n,
- scrisoarea care desemnează orbital de tip (în subshell, l), și
- Un exponent număr care desemnează numărul de electroni în special subshell.
De exemplu, notația 2p4 (a se citi „două–p–patru”) indică patru electroni într-un p subshell (l = 1), cu numărul cuantic principal (n) 2. Notația 3d8 (a se citi „trei–d–opt”) indică opt electroni în d subshell (de exemplu,,, l = 2) din învelișul principal pentru care n = 3.
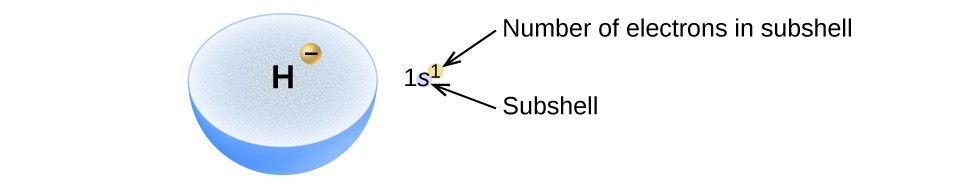
Figura 2. Diagrama unei configurații de electroni specifică subshell (valoarea n și l, cu simbolul literei) și numărul superscript de electroni.
Principiul Aufbau
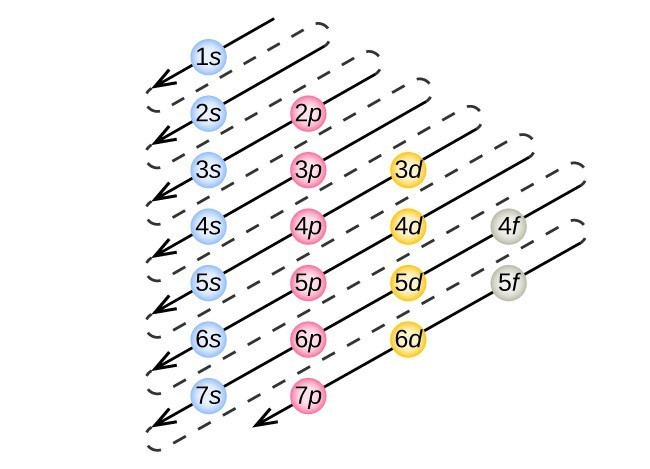
Figura 3. Săgeata conduce prin fiecare subshell în ordinea de umplere corespunzătoare pentru configurații de electroni. Această diagramă este simplu de construit. Pur și simplu face o coloană pentru toate orbitalii s cu fiecare coajă n pe un rând separat., Repetați pentru p, d și f. asigurați-vă că includeți numai orbitele permise de numerele cuantice (nu 1p sau 2d și așa mai departe). În cele din urmă, Desenați linii diagonale de sus în jos, așa cum se arată.pentru a determina configurația electronilor pentru un anumit atom, putem „construi” structurile în ordinea numerelor atomice. Începând cu hidrogen, și continuând de-a lungul perioadelor din tabelul periodic, vom adăuga un proton de la un timp la nucleu și un electron pentru buna subshell până am descris configurațiile electronice ale tuturor elementelor.,această procedură se numește principiul Aufbau, din cuvântul German Aufbau („a construi”). Fiecare electron adăugat ocupă subshell-ul cu cea mai mică energie disponibilă (în ordinea prezentată în Figura 1), sub rezerva limitărilor impuse de numerele cuantice permise în conformitate cu principiul excluderii Pauli. Electronii intră în subshell-urile cu energie mai mare numai după ce subshell-urile cu energie mai mică au fost umplute la capacitate. Figura 3 ilustrează modul tradițional de a aminti ordinea de umplere pentru orbitalii atomici., Deoarece dispunerea tabelului periodic se bazează pe configurațiile electronilor, Figura 4 oferă o metodă alternativă pentru determinarea configurației electronilor. Comanda de umplere începe pur și simplu la hidrogen și include fiecare subshell pe măsură ce continuați în creșterea ordinii Z. De exemplu, după umplerea blocului 3p până la Ar, vedem că orbitalul va fi 4S (K, Ca), urmat de orbitalii 3d.
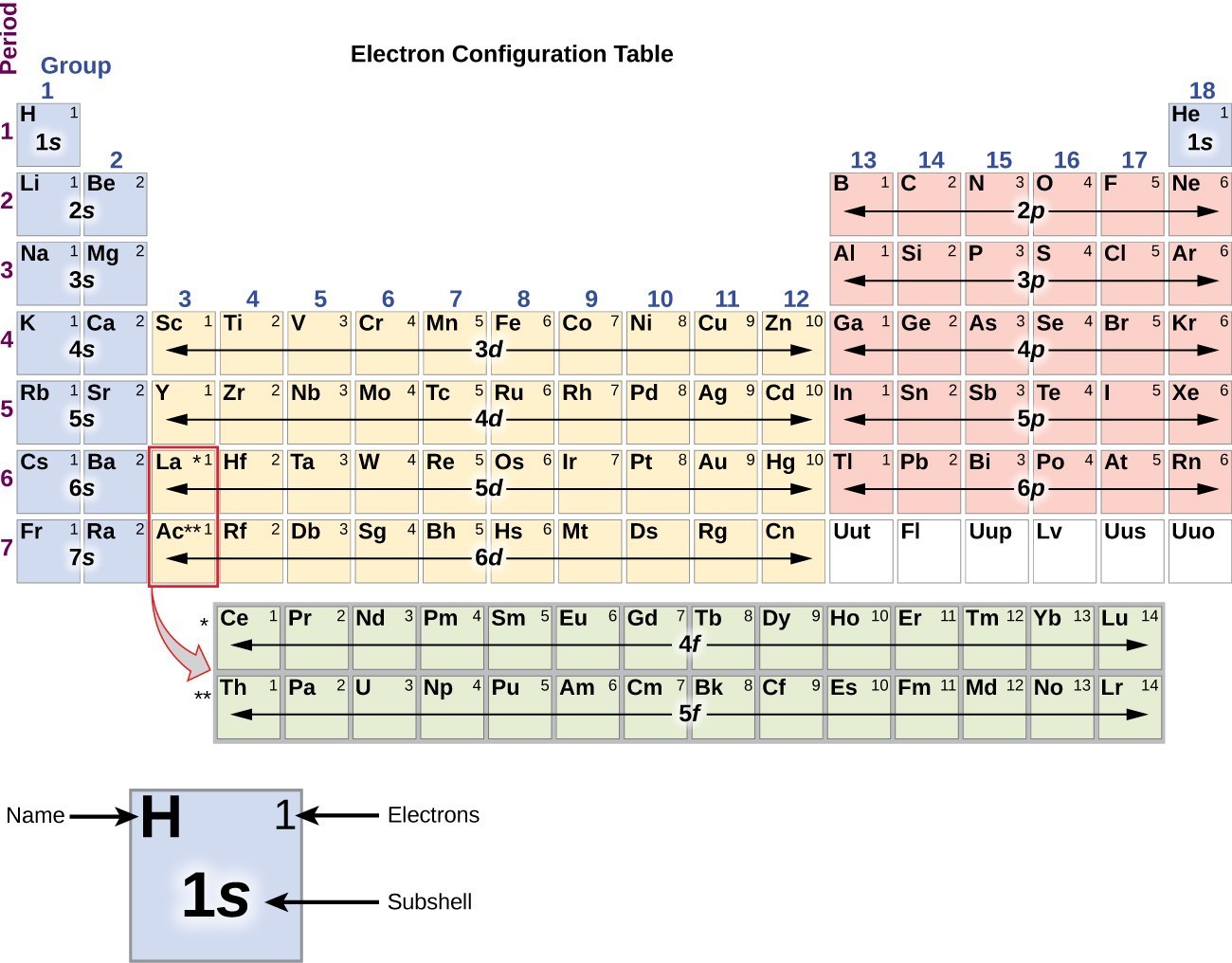
Figura 4. Acest tabel periodic prezintă configurația de electroni pentru fiecare subshell., Prin „construirea” din hidrogen, acest tabel poate fi utilizat pentru a determina configurația electronilor pentru orice atom din tabelul periodic.vom construi acum configurația electronului de la sol și diagrama orbitală pentru o selecție de atomi în prima și a doua perioadă a tabelului periodic. Diagramele orbitale sunt reprezentări picturale ale configurației electronilor, arătând orbitalii individuali și aranjamentul de împerechere al electronilor. Începem cu un singur atom de hidrogen (numărul atomic 1), care constă dintr-un proton și un electron., Referindu-ne la Figura 3 sau figura 4, Ne-am aștepta să găsim electronul în orbitalul 1s. Prin convenție, valoarea {m} _ {s}=+ \ frac{1}{2} este de obicei umplută mai întâi. Configurația electronului și diagrama orbitală sunt:

următorul hidrogen este heliul gazos nobil, care are un număr atomic de 2. Atomul de heliu conține doi protoni și doi electroni. Primul electron are aceleași patru numere cuantice ca electronul atomului de hidrogen (n = 1, l = 0, ml = 0, {m}_{s}=+\frac{1}{2} ). Al doilea electron intră, de asemenea, în orbitalul 1s și umple acel orbital., Al doilea electron are aceleași numere cuantice n, l și ml, dar trebuie să aibă numărul cuantic de spin opus, {m}_{s}=-\frac{1}{2}. Acest lucru este în acord cu principiul excluderii Pauli: nici doi electroni din același atom nu pot avea același set de patru numere cuantice. Pentru diagramele orbitale, aceasta înseamnă că două săgeți merg în fiecare cutie (reprezentând doi electroni în fiecare orbital), iar săgețile trebuie să indice în direcții opuse (reprezentând rotiri pereche)., Configurația electronului și diagrama orbitală a heliului sunt:

carcasa n = 1 este complet umplută într-un atom de heliu.
următorul atom este litiul metalic alcalin cu un număr atomic de 3. Primii doi electroni din litiu umplu orbitalul 1s și au aceleași seturi de patru numere cuantice ca și cei doi electroni din heliu. Electronul rămas trebuie să ocupe orbitalul celei mai mici energii următoare, orbitalul 2S (Figura 3 sau figura 4)., Astfel, configurația electronică și orbitale diagrama de litiu sunt:
Un atom de metal alcalino-beriliu, cu un număr atomic de 4, conține patru protoni în nucleu și patru electroni din jurul nucleului. Al patrulea electron umple spațiul rămas în orbitalul 2S.

un atom de bor (numărul atomic 5) conține cinci electroni. Învelișul n = 1 este umplut cu doi electroni și trei electroni vor ocupa învelișul n = 2., Deoarece orice subshell s poate conține doar doi electroni, al cincilea electron trebuie să ocupe următorul nivel de energie, care va fi un orbital 2P. Există trei orbite degenerate 2P (ml = -1, 0, +1) și electronul poate ocupa oricare dintre aceste orbite P. Atunci când desenăm diagrame orbitale, includem cutii goale pentru a descrie orice orbite goale în aceeași subshell pe care o umplem.

carbonul (numărul atomic 6) are șase electroni. Patru dintre ele umple orbitalele 1s și 2s. Ceilalți doi electroni ocupă subshell-ul 2p., Avem acum posibilitatea de a umple unul dintre orbitalii 2p și de a asocia electronii sau de a lăsa electronii nepereche în două orbite p diferite, dar degenerate. Orbitalii sunt umpluți așa cum este descris de regula lui Hund: cea mai mică configurație de energie pentru un atom cu electroni într-un set de orbitali degenerați este aceea care are numărul maxim de electroni nepereche. Astfel, cei doi electroni din orbitalii carbon 2P au numere cuantice n, l și ms identice și diferă în numărul lor cuantic ml (în acord cu principiul excluderii Pauli)., Configurația electronică și orbitale diagrama de carbon sunt:

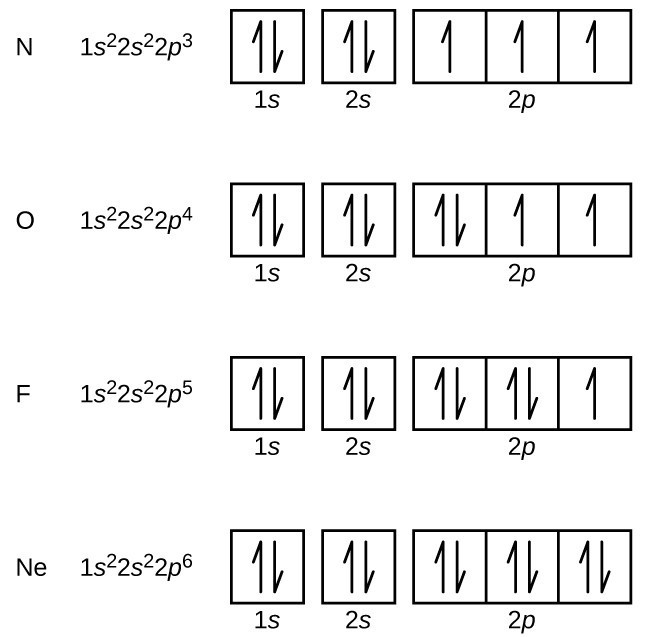
de Azot (numărul atomic 7) umple 1s și 2s subshells și are un electron în fiecare dintre cele trei orbitali 2p, în conformitate cu regula lui Hund. Acești trei electroni au rotiri nepereche. Oxigenul (numărul atomic 8) are o pereche de electroni în oricare dintre orbitalii 2p (electronii au rotiri opuse) și un singur electron în fiecare dintre celelalte două. Fluorul (numărul atomic 9) are doar un orbital 2P care conține un electron nepereche., Toți electronii din neonul de gaz nobil (numărul atomic 10) sunt împerecheați, iar toate orbitalele din cochilii n = 1 și n = 2 sunt umplute. Configurațiile electronice și diagramele orbitale ale acestor patru elemente sunt:
sodiul metalic alcalin (numărul atomic 11) are un electron mai mult decât atomul neon. Acest electron trebuie să meargă în cel mai mic-de energie subshell disponibile, 3s orbital, oferind o 1s22s22p63s1 de configurare., Electronii care ocupă orbitalul(orbitalii) exterior (e) (cea mai mare valoare a lui n) se numesc electroni de valență, iar cei care ocupă orbitalii interiori se numesc electroni de bază (Figura 5). Deoarece învelișurile de electroni de bază corespund configurațiilor de electroni de gaz nobil, putem abrevia configurațiile de electroni scriind gazul nobil care se potrivește cu configurația de electroni de bază, împreună cu electronii de valență într-un format condensat. Pentru exemplul nostru de sodiu, simbolul reprezintă electronii de bază (1s22s22p6), iar configurația noastră abreviată sau condensată este 3s1.,

Figura 5. O configurație de electroni abreviată de bază (dreapta) înlocuiește electronii de bază cu simbolul gazului nobil a cărui configurație se potrivește cu configurația de electroni de bază a celuilalt element.în mod similar, configurația abreviată a litiului poate fi reprezentată ca 2s1, unde reprezintă configurația atomului de heliu, care este identică cu cea a carcasei interioare umplute a litiului. Scrierea configurațiilor în acest fel subliniază similitudinea configurațiilor de litiu și sodiu., Ambii atomi, care se află în familia metalelor alcaline, au un singur electron într-o subshell de valență în afara unui set umplut de cochilii interioare.
\begin{array}{l}\text{Li:}\left2{s}^{1}\\ \text{Na:}\left3{s}^{1}\end{array}
alcalino-metal de magneziu (atomic cu numărul 12), cu 12 electroni într-un 3s2 de configurare, este analog său membru de familie beriliu, 2s2. Ambii atomi au un subshell s umplut în afara cochilii lor interioare umplute., Aluminiu (număr atomic 13), cu 13 electroni și configurația electronică 3s23p1, este analog său membru de familie bor, 2s22p1.
configurații de electroni de siliciu (14 electroni), fosfor (15 electroni), sulf (16 electroni), clor (17 electroni) și argon (18 electroni) sunt analoage în configurații de electroni din învelișul electronic corespunzătoare membrii familiei de carbon, azot, oxigen, fluor, și neon, respectiv, cu excepția faptului că numărul cuantic principal de invelisul exterior al elementelor mai grele a crescut cu unu la n = 3., Figura 6 prezintă cea mai mică energie, sau starea solului, configurația electronului pentru aceste elemente, precum și cea pentru atomii fiecăruia dintre elementele cunoscute.

Figura 6. Această versiune a tabelului periodic prezintă configurația electronică exterioară a fiecărui element. Rețineți că în fiecare grup, configurația este adesea similară.când ajungem la următorul element din tabelul periodic, potasiul metalelor alcaline (numărul atomic 19), ne-am putea aștepta să începem să adăugăm electroni la subshell-ul 3D., Cu toate acestea, toate dovezile chimice și fizice disponibile indică faptul că potasiul este ca litiul și sodiul și că următorul electron nu este adăugat la nivelul 3d, ci este, în schimb, adăugat la nivelul 4s (Figura 6). Așa cum am discutat anterior, orbitalul 3D fără noduri radiale are o energie mai mare, deoarece este mai puțin penetrant și mai protejat de nucleu decât 4S, care are trei noduri radiale. Astfel, potasiul are o configurație electronică de 4s1. Prin urmare, potasiul corespunde Li și Na în configurația sa de coajă de valență., Următorul electron este adăugat pentru a completa subshell-ul 4s, iar calciul are o configurație electronică de 4S2. Acest lucru conferă calciului o configurație de electroni cu coajă exterioară corespunzătoare celei de beriliu și magneziu.începând cu scandiul metalului de tranziție (numărul atomic 21), electroni suplimentari sunt adăugați succesiv la subshell-ul 3D. Acest subshell este umplut la capacitate cu 10 electroni (amintiți-vă că pentru l = 2 , există 2l + 1 = 5 valori de ml, ceea ce înseamnă că există cinci orbitali d, care au o capacitate combinată de 10 electroni). Subshell-ul 4P se umple în continuare., Rețineți că pentru trei serii de elemente, scandiu (Sc) prin cupru (Cu), ytriu (Y) prin intermediul argint (Ag), și lutețiu (Lu) prin aur (Au), un total de 10 d electronii sunt adăugate succesiv la (n – 1) coajă de lângă n shell pentru a aduce asta (n – 1) coajă de la 8 la 18 electroni. Pentru două serii, de lantan (La) prin lutețiu (Lu) și actiniului (Ac) prin laurentiumul (Lr), 14 f electroni (l = 3, 2l + 1 = 7 ml valori; astfel, șapte orbitali cu o capacitate combinată de 14 electroni) sunt adăugate succesiv la (n – 2) shell pentru a aduce acea coajă de 18 electroni de la un total de 32 de electroni.,
Exemplul 1: numere cuantice și configurații de electroni
care este configurația electronică și diagrama orbitală pentru un atom de fosfor? Care sunt cele patru numere cuantice pentru ultimul electron adăugat?
verificați învățarea
identificați atomii din configurațiile de electroni date:
- 4s23d5
- 5s24d105p6.
tabelul periodic poate fi un instrument puternic în estimarea configurația electronică a unui element. Cu toate acestea, găsim excepții de la ordinea umplerii orbitalilor care sunt prezentate în Figura 3 sau figura 4., De exemplu, configurațiile electronice (prezentate în Figura 6) ale metalelor de tranziție crom (Cr; număr atomic 24) și cupru (Cu; număr atomic 29), printre altele, nu sunt cele la care ne-am aștepta. În general, astfel de excepții implică subshell-uri cu energie foarte asemănătoare, iar efectele mici pot duce la modificări în ordinea umplerii.în cazul Cr și Cu, constatăm că subshell-urile pe jumătate umplute și complet umplute reprezintă aparent condiții de stabilitate preferată., Această stabilitate este de așa natură încât un electron trece de la 4s in 3d orbital pentru a obține o stabilitate suplimentară de o jumătate umplut 3d subshell (în Cr) sau o umplut 3d subshell (în Uv). De asemenea, apar și alte excepții. De exemplu, niobiul (NB, numărul atomic 41) este prevăzut să aibă configurația electronică 5s24d3. Experimental, observăm că configurația electronului de la sol este de fapt 5s14d4., Putem raționaliza această observație spunând că repulsiile electron-electron experimentate prin împerecherea electronilor în orbitalul 5S sunt mai mari decât decalajul de energie dintre orbitalii 5s și 4D. Nu există o metodă simplă de a prezice excepțiile pentru atomi în care magnitudinea respingerilor dintre electroni este mai mare decât diferențele mici de energie dintre subshells.,așa cum s-a descris mai devreme, tabelul periodic aranjează atomii pe baza creșterii numărului atomic, astfel încât elementele cu aceleași proprietăți chimice să reapară periodic. Când configurațiile lor de electroni sunt adăugate în tabel (Figura 6), vedem, de asemenea, o recurență periodică a configurațiilor de electroni similare în învelișurile exterioare ale acestor elemente. Deoarece se află în cochilii exteriori ai unui atom, electronii de valență joacă cel mai important rol în reacțiile chimice., Electronii exteriori au cea mai mare energie a electronilor dintr-un atom și sunt cel mai ușor pierduți sau împărțiți decât electronii de bază. Electronii de valență sunt, de asemenea, factorul determinant în unele proprietăți fizice ale elementelor.elementele din orice grup (sau coloană) au același număr de electroni de valență; metalele alcaline litiu și sodiu au fiecare un singur electron de valență, metalele alcalino-pământoase beriliu și magneziu au fiecare două, iar halogenii fluor și clor au fiecare șapte electroni de valență., Similitudinea proprietăților chimice între elementele aceluiași grup apare deoarece au același număr de electroni de valență. Este pierderea, câștigul sau împărțirea electronilor de valență care definește modul în care reacționează elementele.este important să ne amintim că tabelul periodic a fost dezvoltat pe baza comportamentului chimic al elementelor, cu mult înainte ca orice idee despre structura lor atomică să fie disponibilă. Acum putem înțelege de ce tabelul periodic are aranjamentul pe care îl are—aranjamentul pune elemente ale căror atomi au același număr de electroni de valență în același grup., Acest aranjament este subliniat în Figura 6, care arată în formă de tabel periodic configurația electronică a ultimului subshell care trebuie completat de principiul Aufbau. Secțiunile colorate din Figura 6 prezintă cele trei categorii de elemente clasificate după orbitalii care sunt completate: grupul principal, tranziția și elementele de tranziție interioară. Aceste clasificări determină orbitalii care sunt numărați în carcasa de valență sau orbitalii cu cel mai înalt nivel de energie al unui atom.,elementele grupului principal (uneori numite elemente reprezentative) sunt cele în care ultimul electron adăugat intră într-un orbital s sau p în învelișul exterior, prezentat în albastru și roșu în Figura 6. Această categorie include toate elementele nemetalice, precum și multe metale și elementele semimetalice intermediare. Electronii de valență pentru elementele grupului principal sunt cei cu cel mai înalt nivel N. De exemplu, galiul (Ga, numărul atomic 31) are configurația electronică 4s23d104p1, care conține trei electroni de valență (subliniați)., Orbitalii d complet umpluți contează ca electroni de bază, nu de valență.
- serie nou: lantanide (La) prin lutețiu (Lu)
- actinide seria: actinide (Ac) prin laurentiumul (Lr)
Lantan și actiniului, pentru că similitudinile lor cu ceilalți membri ai seriei, sunt incluse și folosit pentru numele seriei, chiar dacă acestea sunt metale de tranziție cu nu f electroni.am văzut că ionii se formează atunci când atomii câștigă sau pierd electroni., Un cation (ion încărcat pozitiv) se formează atunci când unul sau mai mulți electroni sunt îndepărtați dintr-un atom părinte. Pentru elementele grupului principal, electronii care au fost adăugați ultima dată sunt primii electroni eliminați. Pentru metale de tranziție și interioare metale de tranziție, cu toate acestea, electronii din orbitali sunt mai ușor de a elimina decât d sau f electroni, și așa mai înalt ns electronii sunt pierdut, și apoi (n – 1)d sau (n – 2)f electronii sunt eliminate. Un anion (ion încărcat negativ) se formează atunci când unul sau mai mulți electroni sunt adăugați la un atom părinte. Electronii adăugați completează ordinea prevăzută de principiul Aufbau.,
Exemplul 2: Estimarea Configurațiile electronice ale Ionilor
Ce este configurația electronică și orbitale diagrama de:
- Na+
- P3–
- Al2+
- Fe2+
- Sm3+
verificați învățarea
care ion cu o încărcare +2 are configurația electronului 1s22s22p63s23p63d104s24p64d5? Care ion cu o încărcare +3 are această configurație?
Concepte-Cheie și Rezumatul
relativă energia subshells a determina ordinea în care atomica orbitalii sunt umplute (1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, și așa mai departe)., Configurațiile electronilor și diagramele orbitale pot fi determinate prin aplicarea principiului excluderii Pauli (nici doi electroni nu pot avea același set de patru numere cuantice) și a regulii lui Hund (ori de câte ori este posibil, electronii păstrează rotiri nepereche în orbitele degenerate).
electronii din orbitele exterioare, numiți electroni de valență, sunt responsabili pentru majoritatea comportamentului chimic al elementelor. În tabelul periodic, elementele cu configurații electronice de valență analogice apar de obicei în cadrul aceluiași grup., Există câteva excepții de la ordinea de umplere prevăzută, în special atunci când se pot forma orbite pe jumătate umplute sau complet umplute. Tabelul periodic poate fi împărțit în trei categorii pe baza orbitalului în care este plasat ultimul electron care urmează să fie adăugat: elementele grupului principal (orbitalii s și p), elementele de tranziție (orbitalii d) și elementele de tranziție interioară (orbitalii f).
încercați
- citiți etichetele mai multor produse comerciale și identificați ionii monatomici ai cel puțin patru elemente de tranziție conținute în produse., Scrieți configurațiile electronice complete ale acestor cationi.
- citiți etichetele mai multor produse comerciale și identificați ionii monatomici din cel puțin șase elemente principale ale grupului conținute în produse. Scrieți configurațiile electronice complete ale acestor cationi și anioni.,
- Utilizarea completă subshell notație (nu abrevieri, 1s22s22p6, și așa mai departe), prezice configurația electronică a fiecăruia din următorii atomi:
- C
- P
- V
- Sb
- Sm
- Utilizarea completă subshell notație (1s22s22p6, și așa mai departe), prezice configurația electronică a fiecăruia din următorii atomi:
- N
- Si
- Fe
- Te
- Tb
- 1s22s22p6 Este simbolul pentru o proprietate macroscopică sau microscopică proprietate a unui element? Explică-ți răspunsul.,
- ce informații suplimentare avem nevoie pentru a răspunde la întrebarea „care ion are configurația electronică 1s22s22p63s23p6”?,
- Atrage orbital diagrama pentru valence shell de fiecare dintre următoarele atomi:
- C
- P
- V
- Sb
- Ru
- Folosiți un orbital diagrama pentru a descrie configurația electronică a valence shell de fiecare dintre următoarele atomi:
- N
- Si
- Fe
- Te
- Mo
- Utilizarea completă subshell notație (1s22s22p6, și așa mai departe), prezice configurații de electroni din următoarele ioni.,
- N3–
- Ca2+
- S
- Cs2+
- Cr2+
- Gd3+
- Care atom are configurația electronică 1s22s22p63s23p64s23d104p65s24d2?
- care atom are configurația electronică 1s22s22p63s23p63d74s2?
- care ion cu o încărcare +1 are configurația electronică 1s22s22p63s23p63d104s24p6? Care ion cu încărcare a -2 are această configurație?
- care dintre următorii atomi conține doar trei electroni de valență: Li, B, N, F, Ne?
- care dintre următoarele are doi electroni nepereche?,
- Mg
- Si
- S
- Ambele Mg și S
- Ambele si și S.
- Care atom ar fi de așteptat să aibă o jumătate pline 6p subshell?
- care atom ar fi de așteptat să aibă o jumătate de umplut 4S subshell?
- într-o zonă din Australia, bovinele nu au prosperat în ciuda prezenței furajelor adecvate. O investigație a arătat că cauza este absența unui cobalt suficient în sol. Cobaltul formează cationi în două stări de oxidare, Co2+ și Co3+. Scrieți structura electronică a celor doi cationi.,
- Taliul a fost folosit ca o otravă în povestea misterului Agatha Christie ” calul palid.”Taliul are două forme cationice posibile, +1 și + 3. Compușii +1 sunt mai stabili. Scrieți structura electronică a cationului + 1 al taliului.
- Scrieți configurațiile electronice pentru următoarele atomi sau ioni:
- B3+
- O–
- Cl3+
- Ca2+
- Ti
- Cobalt–60 și iod–131 sunt izotopi radioactivi frecvent utilizate în medicina nucleară. Câți protoni, neutroni și electroni sunt în atomii acestor izotopi?, Write the complete electron configuration for each isotope.
- Write a set of quantum numbers for each of the electrons with an n of 3 in a Sc atom.





