A Microbial Biorealm page on the genus Pseudomonas aeruginosa
Classification
Higher order taxa
Bacteria
Proteobacteria
Gamma proteobacteria
Pseudomonadales
Pseudomonadaceae
Pseudomonas
Pseudomonas aeruginosa group
Species
NCBI: Taxonomy
Pseudomonas aeruginosa

Descriere și importanță
Pseudomonas aeruginosa este o gram-negative, în formă de tijă, asporogenous, și monoflagellated bacterie care are un incredibil nutritive versatilitate. Este o tijă de aproximativ 1-5 µm lungime și 0,5-1,0 µm lățime. P. aeruginosa este o obliga respirer, folosind respirația aerobă (cu oxigen), ca sa optimă metabolismul deși poate, de asemenea, respira anaerob pe nitrați sau alte alternative de electroni acceptori. P., aeruginosa poate cataboliza o gamă largă de molecule organice, inclusiv compuși organici, cum ar fi benzoatul. Acest lucru face ca P. aeruginosa să fie un microorganism foarte omniprezent, deoarece a fost găsit în medii precum solul, apa, oamenii, animalele, plantele, canalizarea și spitalele (1). În toate oligotropic ecosistemelor acvatice, care conțin ridicat de oxigen dizolvat, dar conținutul scăzut de substanțe nutritive a plantelor de-a lungul, P. aeruginosa este predominant de locuitor, iar acest lucru îl face cel mai abundent organism de pe pământ (2).P. aeruginosa este un agent patogen oportunist uman., Este „oportunist”, deoarece rareori infectează persoanele sănătoase. În schimb, deseori colonizează pacienții imunocompromiși, cum ar fi cei cu fibroză chistică, cancer sau SIDA (3). Este un agent patogen atât de puternic încât, în primul rând, atacă două treimi din pacienții spitalizați în stare critică, iar acest lucru prezintă, de obicei, boli mai invazive. În al doilea rând, P. aeruginosa este un agent patogen oportunist Gram-negativ în majoritatea centrelor medicale, care are o rată de mortalitate de 40-60%., În al treilea rând, complică 90% din decesele cauzate de fibroza chistică; și, în sfârșit, este întotdeauna listat ca unul dintre primii trei agenți patogeni Gram-negativi cei mai frecvenți și este legat de cele mai grave boli vizuale (4). În plus, P. aeruginosa este un foarte important sol bacterie care este capabil de rupere jos hidrocarburi aromatice policiclice și de a face rhamnolipids, chinolone, cianura de hidrogen, phenazines, și lectine (5). De asemenea, prezintă rezistență intrinsecă la o mulțime de tipuri diferite de agenți chimioterapeutici și antibiotice, ceea ce îl face un agent patogen foarte greu de eliminat (1).,
P. aeruginosa a fost descrisă pentru prima dată ca o specie bacteriană distinctă la sfârșitul secolului al XIX-lea, după dezvoltarea mediilor de cultură sterile de către Pasteur. În 1882, primul studiu științific despre P. aeruginosa, intitulat „despre colorarea albastră și verde a bandajelor”, a fost publicat de un farmacist numit Carle Gessard. Acest studiu a arătat pigmentarea caracteristică a lui P. aeruginosa: P., aeruginosa a produs pigmenți solubili în apă, care, la expunerea la lumina ultravioletă, fluorescentă lumină albastru-verde. Ulterior, aceasta a fost atribuită pyocyanine, un derivat de phenazine, și, de asemenea, reflectată organismului vechi denumiri: genul bacillus pyocyaneus, Bakterium aeruginosa, Pseudomonas polycolor maimeri, și Pseudomonas pyocyaneus (3). P. aeruginosa are multe tulpini, inclusiv Pseudomonas aeruginosa tulpina PA01, Pseudomonas aeruginosa PA7, Pseudomonas aeruginosa tulpina UCBPP-PA14, și Pseudomonas aeruginosa tulpina 2192 (5)., Cele mai multe dintre acestea au fost izolate pe baza lor distinctive grapelike miros de aminoacetophenone, pyocyanin de producție, și coloniile structura pe agar mass-media (6).P. aeruginosa are dimensiunea genomului de aproximativ 5, 2 până la 7 milioane de perechi de baze (Mbp) cu 65% conținut de guanină + citozină. Este o combinație de segmente accesorii variabile și un miez conservat. Genomul accesoriu variabil este caracterizat printr-un set de insule genomice și insulițe dintr-un tip de insulă integrat primordial Tarn. Genomul de bază constă dintr-un nivel scăzut de divergență nucleotidică de 0.,5% și o sintenie conservată a genelor, ceea ce înseamnă că două sau mai multe gene, indiferent dacă sunt legate sau nu, se află pe același cromozom (7).

P. aeruginosa are un cromozom circular unic și supracolat în citoplasmă (4). De asemenea, poartă o mulțime de plasmide mobilizatoare de cromozomi care sunt foarte semnificative pentru stilul de viață al organismului ca agent patogen., Plasmidele, TEM, OXA și PSE, de exemplu, sunt codificate pentru producerea betalactamazei, care este necesară pentru rezistența sa la antibiotice, permițând astfel P. aeruginosa să fie un agent patogen formidabil (8).,
Cele două tulpini care au genomul complet secvență sunt Pseudomonas aeruginosa PA01 și Pseudomonas aeruginosa PA14 (9):
– În anul 2000, un grup de voluntari „Pseudomonas” oamenii de știință, inclusiv cei de la Washington Patogeneza Corportaion și Departamentul de Biologie de la Universitatea din California, San Diego, a lucrat sub Pseudomonas aeruginosa Comunitar Adnotare Proiect (PseudoCAP) de a publica secventa completa a genomului de Pseudomonas aeruginosa PA01., Acest lucru s-a făcut deoarece cunoașterea secvenței genomice ar oferi noi informații despre această bacterie ca agent patogen și despre versatilitatea sa ecologică și complexitatea genetică. La 6,264,403 perechi de baze, genomul său bacterian este cel mai mare care a fost secvențiat vreodată. De asemenea, conține 5.570 de cadre de citire deschise prezise (ORFs) și, astfel, are aproape complexitatea genetică a eucariotelor simple, cum ar fi Saccharomyces cerevisiae. Folosind eșantionarea genomului întreg, genomul complet de 6,3 Mbp al Pseudomonas aeruginosa PA01 este foarte asemănător cu P., harta fizică a aeruginosa, cu o singură excepție majoră, care este inversarea a aproximativ un sfert din genomul Pseudomonas aeruginosa PA01. Această inversiune provine din recombinarea omologă a loci rrnA și rrnB, iar studiile anterioare privind inversiunile secvenței genomice ale loci ADN ribozomal în S. typhimurium și E. coli sugerează că această inversiune ar putea avea semnificație adaptivă (10).
–secvența completă a genomului Pseudomonas aeruginosa PA14 este în prezent realizată de oamenii de știință de la Harvard Medical School., Scopul acestui studiu este realizarea unei date publice a genomului Pseudomonas aeruginosa PA14. Faza de secvențiere a proiectului a fost finalizată în 2005, obținându-se 6,54 Mbp de secvență PA14. Acesta este în prezent în curs comparativ cu genomul de Pseudomonas aeruginosa PA01 și rezultatele preliminare au arătat că acestea sunt foarte similare, dar au mai multe regiuni de marcat diferențe, cum ar fi introducerea de 107911bp în PA14, care este absent în PA01. Aproximativ, nu este 96.3% din secvența de ADN de PAO1 este în PA14, și 92,4% din PA14 secvență de ADN este în PA01 (11).,
structura și metabolismul celulelor
proteina F–deoarece P. aeruginosa este un microb Gram-negativ, are o membrană exterioară care conține proteina F (OprF). OprF funcționează ca porin, permițând anumitor molecule și ioni să intre în celule și ca o proteină structurală, menținând forma celulelor bacteriene. Deoarece OprF furnizează membrana exterioară P. aeruginosa cu o limită de excludere de 500 Da, scade permeabilitatea membranei exterioare, o proprietate dorită deoarece ar scădea aportul de substanțe nocive în celulă și ar da P., aeruginosa o rezistență ridicată la antibiotice (12).Flagellum și Pili – P. aeruginosa folosește flagelul său unic și polar pentru a se deplasa și pentru a afișa chemotaxia moleculelor utile, cum ar fi zaharurile. Tulpinile sale au fie tip A, fie tip B de flagelă, o clasificare care se bazează în principal pe mărimea și antigenicitatea subunității flagelinei. Flagelul este foarte important în stadiile incipiente ale infecției, deoarece se poate atașa și invada țesuturile gazdelor (13). Similar cu flagelul său, P., aeruginosa pili contribuie foarte mult la capacitatea sa de a adera la suprafețele mucoase și celulele epiteliale. Mai exact, vârful pili este responsabil pentru aderarea la suprafața celulei gazdă. P. aeruginosa au N-metil-fenil-alanină (NMePhe) sau pili de tip IV (1). Pilii sunt caracterizați ca filamente polare lungi formate din homopolimeri din pilina proteică, care este codificată de gena pilA (4). În General, P., aeruginosa flagellum și pili au o funcționalitate similară (pentru atașare) și structură (ambele sunt structuri filamentoase pe suprafața celulei), iar motilitatea lor este controlată de RpoN, în special în timpul atașării inițiale la gazda umană și în condiții de nutrienți scăzute (1).
când infectează gazda, P., aeruginosa este înfometată pentru fier, deoarece privarea de fier a unui agent patogen infecțios este partea cheie a mecanismului de apărare înnăscut al oamenilor. Pentru a depăși această provocare, P. aeruginosa sintetizează doi siderofori: pyochelin și pyoverdin. P. aeruginosa secretă apoi acești sideofori în exteriorul celulei, unde se leagă strâns de fier și aduc fierul înapoi în celulă. În plus, P. aeruginosa pot folosi, de asemenea, fier de enterobactin, special siderophore produse de E. coli pentru fier de transport, pentru a satisface nevoie de fier (14).
P., aeruginosa este un aerob facultativ; metabolismul său preferat este respirația. Câștigă energie prin transferul electronilor de la glucoză, un substrat redus, la oxigen, acceptorul final de electroni (15). Defalcarea glucozei necesită oxidarea la gluconat în periplasmă, apoi va fi adusă în interiorul membranei interioare printr-un sistem specific de absorbție a gluconatului dependent de energie. Odată ajuns în interior, gluconatul este fosforilat la 6-p-gluconat, care va intra în metabolismul central pentru a produce energie pentru celulă (16). Când P. aeruginosa este în condiții anaerobe, cu toate acestea, P., aeruginosa folosește nitratul ca acceptor de electroni terminali (17). În condiții de stres oxidativ, P. aeruginosa sintetizează enzimele superoxid dismutază (SOD) care conțin Fe sau Mn, care catalizează O – la H2O2 și O2 foarte reactive. De asemenea, detoxifică H2O2 la O2 și H2O prin utilizarea catalazei (1).deoarece P. aeruginosa poate trăi atât în medii neînsuflețite, cât și în medii umane, a fost caracterizat ca un microorganism „omniprezent”. Această versatilitate este posibilă datorită unui număr mare de enzime care permit P. aeruginosa să utilizeze o diversitate de substanțe ca nutrienți., Cel mai impresionant, P. aeruginosa poate trece de la creșterea pe medii nonmucoide la mucoide, care vine cu o sinteză mare de alginat. În mediul neînsuflețit, P. aeruginosa este de obicei detectat în rezervoarele de apă poluate de animale și oameni, cum ar fi canalizarea și chiuvetele din interiorul și exteriorul spitalelor. Se găsește, de asemenea, în piscine și vârtejuri, deoarece temperaturile calde sunt favorabile creșterii sale (3)., Cu toate acestea, deoarece a prosperat în condiții calde, s-a stabilit că este vinovat de erupția cu cada fierbinte, în care contactul direct dintre piele și apa infectată din cadă va face ca pielea infectată să fie mâncărime și să o transforme într-o culoare roșie denivelată (19). În plus, P. aeruginosa este un agent patogen uman oportunist care provoacă infecții cronice la pacienții cu fibroză chistică și este principala cauză de deces de către bacteriile Gram-negative (mai mult sub patologie) (3).deși majoritatea interacțiunilor P. aeruginosa-plantă sunt dăunătoare plantei, un studiu recent a găsit un P., tulpina aeruginosa care susține de fapt creșterea plantelor. Această caracteristică, împreună cu faptul că P. aeruginosa poate degrada hidrocarburile aromatice policiclice, sugerează viitoarele utilizări ale P. aeruginosa pentru detoxifierea ecologică a substanțelor chimice sintetice și a pesticidelor și în scopuri industriale (3). Psuedomonas aeruginosa este unic datorită capacității sale de a infecta atât oamenii, cât și plantele, unul dintre puținele organisme care pot infecta ambele regate.
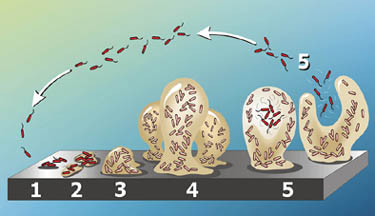
Patologia

P. aeruginosa rareori cauzează boala la oameni sănătoși., De obicei, este legat de pacienții al căror sistem imunitar este compromis de boli sau traume. Obține acces la țesuturile acestor pacienți prin arsuri, pentru victimele arsurilor sau printr-o boală subiacentă, cum ar fi fibroza chistică. În primul rând, P. aeruginosa aderă la suprafețele țesuturilor folosind flagelul, pili și exo-S; apoi, se reproduce pentru a crea o masă critică infecțioasă; și, în sfârșit, face leziuni tisulare folosind factorii de virulență (21). Deoarece exotoxinele puternice și endotoxinele eliberate de P. aeruginosa în timpul bacteremiilor continuă să infecteze gazda chiar și după P., aeruginosa a fost ucis de antibiotice, boli acute cauzate de P. aeruginosa tind să fie cronice și pune viața în pericol. Mai mult, cu excepția tulpinii de fibroză chistică, majoritatea tulpinilor de P. aeruginosa care atacă pacienții compromiși tind să fie nonmucoide (2). Și chiar dacă o cantitate mică de pacienți infectați cu P. aeruginosa au dezvoltat sepsis sever cu leziuni cu centre negre, majoritatea pacienților nu au prezentat efecte patologice evidente ale colonizării (22).fibroza chistică (FC) este cea mai frecventă afecțiune autozomală recesivă la caucazieni., Cu o mutație pe cromozomul 7, un plămân CF nu poate transporta clorură (Cl-), sodiu (Na+) și apă de la bazolateral la epiteliul secretor. Această întrerupere a echilibrului de sare și apă din celulă are ca rezultat producerea unui mucus gros, care devine locuința ideală pentru potențialii agenți patogeni. P. aeruginosa atacă pacienții cu CF prin căile respiratorii și, odată intrat, își folosește flagelul pentru a merge în zona hipoxică, un mediu epuizat de oxigen. În această locație, P. aeruginosa suferă o tranziție de la un microb aerob la un microb anaerob și începe să formeze biofilme anaerob., Odată ce acest lucru este format, P. aeruginosa în această comunitate poate simți populația lor prin cvorum sensing, în cazul în care acestea secretă feromoni cu greutate moleculară mică, care le permit să comunice între ele (23). Acest lucru le dă capacitatea de a rezista mai multe de apărare, inclusiv anti-Pseudomonas antibiotice, cum ar fi ticarcillin, ceftazidim, tobramicina, și ciprofloxacină, pentru că odată ce bacteriile sensul că lor exterior strat de biofilm este distrus, straturile interioare va deveni mai puternică pentru a restabili comunitate (24). P., aeruginosa este, de asemenea, rezistent la multe antibiotice și agenți chimioterapeutici datorită rezistenței lor intrinseci. Aceasta este cauzată de permeabilitatea scăzută la antibiotice a membranei exterioare și de producerea de β-lactamaze împotriva pompelor de eflux multidrog și a antibioticelor β-lactamice (22).P. aeruginosa comunică cu alte celule prin detectarea cvorumului. Această formă de comunicare permite celulelor să regleze producția de gene, ceea ce duce la controlul anumitor funcții celulare. Una dintre enzimele responsabile pentru detectarea cvorumului este tirozin fosfataza (TpbA)., Această enzimă transmite semnale extracelulare de detectare a cvorumului la producerea polizaharidelor și formarea biofilmului în afara celulelor (32). P. aeruginosa se atașează de suprafețe prin producerea de biofilme. Quorum-sensing poate fi o țintă de droguri pentru a vindeca infecțiile cauzate de P. aeruginosa. Quorum-quenching este folosit pentru a bloca mecanismul de semnalizare de cvorum-sensing și previne formarea biofilmului în P. aeruginosa. Yi-Hu Dong și colegii săi au reușit să prevină formarea biofilmului la șoareci în condiții de laborator (33). P. aeruginosa secretă mulți factori virulenți pentru a coloniza celulele gazdei sale., De exemplu, exotoxina A, cea mai toxică proteină produsă de P. aeruginosa, catalizează ribozilarea ADP pentru a forma ADP-ribozil-EF-2, care inhibă sinteza proteinelor celulelor gazdei. Mai mult, elastaza, o protează extracelulară de zinc, atacă proteinele eucariote, cum ar fi colagenul și elastina și distruge proteinele structurale ale celulei. De asemenea, descompune imunoglobina umană și proteinele alfa serice (1).mai mult, P. aeruginosa infectează animalele. Într-un experiment, injectarea intravenoasă de p virulent., aeruginosa a fost injectat la șoareci și aceste animale au murit de obicei în 24-48 de ore. Când a fost injectată o doză mai mică, ar avea loc semne caracteristice de infecție, cum ar fi pierderea în greutate, leziuni focale în ficat, splină și rinichi, urmate de deces în 3-10 zile. De asemenea, s-a constatat că P. aeruginosa provoacă focare de pneumonie la cobai și, deși atacă și plantele, nu s-au făcut multe cercetări în acest domeniu (22).Pseudomonas aeruginosa este un agent patogen oportunist omniprezent din punct de vedere ecologic. Infecțiile epidermice rezultă adesea din P., aeruginosa se infiltrează prin prima linie de apărare a gazdei umane, intrând în corp prin piele la locul unei răni deschise. P. aeruginosa este un membru comun al Comunităților bacteriene spitalicești unde poate infecta persoanele imunocompromise, inclusiv victimele arsurilor. P. aeruginosa este o sursă de bacteriemie la victimele arsurilor . În urma afectării severe a pielii, prevalența P. aeruginosa în mediu crește probabilitatea ca organismul să acceseze fluxul sanguin prin țesutul epidermal profund expus al victimei arse ., Cercetările anterioare ale apărării gazdei mediate de anticorpi indică faptul că în a cincea zi după arderea inițială, expresia receptorului Fc este redusă în leucocitele polimorfonucleare (PMNs). Fără receptorul Fc, chemotaxia PMN este mult redusă, iar PMN-urile devin mai puțin eficiente în prevenirea infecțiilor .P. aeruginosa poate fi transmisă unei gazde prin fomiți, vectori și lucrători spitalicești care sunt potențiali purtători pentru tulpini rezistente la antibiotice ale agentului patogen. Mai mult, orice P., aeruginosa deja prezentă pe pielea unei victime arse înainte de rănire se poate transforma dintr-un organism inofensiv pe suprafața pielii într-o sursă de infecție în sângele și țesuturile corpului aceluiași individ . pili și flagelul lui P. aeruginosa joacă un rol vital în infectarea arsurilor și a rănilor . Infecția controlată a rănilor de arsură pe modele animale și vegetale cu tulpini de P. aeruginosa lipsite de pili și flagelă demonstrează o tendință de scădere a virulenței., Fără acești factori de virulență morfologică, bacteriile prezintă o rată de supraviețuire substanțial scăzută la locul plăgii și o capacitate scăzută de diseminare în organismul gazdă . Răspândirea P. aeruginosa în organismele gazdă depinde, de asemenea, de producția de elastază a microorganismului și de alte mecanisme de protează. Elastaza bacteriană și alte proteaze bacteriene degradează proteinele gazdei, inclusiv proteinele structurale din membrane, perturbând barierele fizice ale gazdei împotriva răspândirii infecției. Elastaza ajută, de asemenea, P., aeruginosa în evitarea citotoxicității mediate de anticorpi fagocitotici la locul plăgii prin inhibarea chemotaxiei monocitare .
de Identificare:
Macro morfologie (miros):
Large, flat and greenish colonies (2-4 mm in diameter) with irregular edges and typical metallic luster. The color is most visible on for instance TS-agar. Sometimes, a clear hemolysis zone is obtained on blood agar. Has distinctive smell (caramel, strawberry or raspberry soda). Some strains produce a green fluorescent pigment, pyoverdine. Some strains can also produce a blue pigment, pyocyanin.
Micromorfologie:Mici urme de rod (0.5-0.8 x 1,5-3 µm) cu un monotrichous flagel.
Gram -:
Fig. 65:5.Colorarea Gram a Pseudomonas aeruginosa, tulpina ATCC 27853. Câmpul B este o mărire parțială (de 3 ori) A. lungimea barei de scală corespunde la 5 µm. Data: 2011-03-24., G –
Metabolism: este adesea clasificat ca aerobic, dar poate exploata și NO3-ca acceptor final de electroni în lanțul respirator. Ar trebui, prin urmare, să fie clasificate ca facultativ anaerobe!
catalază / oxidază: + / + Triptofanază-citrat +, roșu de metil -, Voges-Proskauer -.P. aeruginosa, precum și multe alte Pseudomonas, pot degrada hidrocarburile aromatice, cum ar fi metilbenzenii, care sunt subprodusele industriilor petroliere și sunt utilizate în mod obișnuit ca solvenți pentru emailuri și vopsele, precum și în producția de medicamente și substanțe chimice., Metilbenzenii sunt considerați contaminanți ai mediului care sunt prezenți în atmosferă, subteran și soluri și în apele de suprafață (25). P. aeruginosa poate descompune toluenul, cea mai simplă formă de metilbenzen. P. aeruginosa degradează toluenul prin oxidarea grupării metil la aldehidă, alcool și un acid, care este apoi transformat în catechol. Prin urmare, P. aeruginosa poate fi utilizat în controlul poluării (26).,
Curent de Cercetare
Efectul de Zbor spatial pe Microbiene Expresia Genelor și Virulență (Microb)
–Administrația Națională de Aeronautică și spațiu (NASA) și Institutul de Biodesign de la Universitatea de Stat din Arizona desfășoară în prezent un proiect de cercetare numit experimentul microbilor., În acest experiment, trei agenți patogeni microbieni Pseudomonas aeruginosa, Salmonella typhimurium și Candida albicans sunt aduși în spațiu pentru a vedea cum se schimbă răspunsurile lor genetice și virulența. Acești trei microbi au fost considerați o potențială amenințare la adresa sănătății astronauților, deoarece P. aeruginosa a contaminat sistemul de apă al navei spațiale și a infectat un membru al echipajului în timpul erei Apollo., Astfel, înțelegerea adaptării și virulenței lor în microgravitate va oferi oamenilor de știință mai multe informații despre mediul spațial al echipajului și va pregăti mai bine astronauții pentru viitoarele explorări spațiale. Microbii au fost plasați în interiorul camerelor de cultură autonome și, la aterizarea pe pământ, o treime din probă va fi utilizată pentru studii de virulență, în timp ce restul va fi păstrat înghețat la-80oC., Deoarece acesta este un proiect de cercetare în curs de desfășurare, nu au existat rezultate, dar oamenii de știință NASA sunt foarte încrezători că acest studiu va duce la descoperiri noi de vaccinuri împotriva acestor microbi aici pe Pământ și în timpul zborului spațial (27).combinația dintre PCR și Serologie crește diagnosticul de colonizare/infecție Pseudomonas aeruginosa în fibroza chistică
–metodele de cultivare microbiologică sunt adesea utilizate pentru diagnosticarea precoce a infecției cu P. aeruginosa la pacienții cu fibroză chistică (CF). Aceste metode, cu toate acestea, au unele dezavantaje, deoarece P., este posibil ca aeruginosa să nu fie detectată, deoarece infecția inițială este de obicei în densitate scăzută. S-a propus apoi ca serologia și reacția în lanț a polimerazei (PCR) să fie tehnici mai bune în detectarea stadiului incipient al infecției cu P. aeruginosa la copiii cu FC. Experimentul a fost realizat prin colectarea sputei și a serului de la 87 de copii CF cu vârsta medie de 9,7 ani. Apoi, 1) PCR a fost efectuat pe spută, vizând P. aeruginosa algD GDP manoză dehidrogenază gena.2) serologia a fost făcută împotriva antigenelor P. aeruginosa: exotoxina A, elastaza și proteaza alcalină.,3) a fost făcută o combinație de PCR și serologie.Atunci când se analizează rezultatele, utilizarea metodei PCR sau serologie în monoterapie nu a produs diferențe semnificative statistic față de metodele de cultură microbiologică. Cu toate acestea, combinația dintre PCR și serologie a identificat mult mai mulți pacienți decât oricare dintre cele două metode singure. Prin urmare, o metodă combinată care include PCR va fi o tehnică precisă de utilizat în diagnosticul precoce al colonizării P. aeruginosa la pacienții cu CF (28).,
Genomice analiză relevă faptul că Pseudomonas aeruginosa virulența este combinatorie
–Comparație între P. aeruginosa PA01 tulpina și mai virulente P. aeruginosa PA14-a fost făcut de identitate noi gene de virulență. În primul rând, secvențierea genomului pușcă a fost făcută pe PA14 folosind 65.800 plasmide cu fragmente de 2-4 kb de ADN PA14. Apoi, a fost implementată o metodă bazată pe PCR cu rază lungă de acțiune pentru a determina dacă anumite genomi P. aeruginosa sunt similari cu genomii PA01 sau PA14. S-a constatat că, deși PA14 gemone (6.5 Mbp) este oarecum mai mare decât cea a PA01 (6.,3 Mbp), genomurile PA14 și PA01 sunt foarte asemănătoare. Erau 58 de gene clustere din PA14 care au fost lipsă în PA01 și s-a presupus că unele dintre aceste gene sunt ceea ce face PA14 mult mai virulent decât PA01. Genotiparea Microarray a 18 tulpini diverse în modelul C. elegans, totuși, a arătat că acele 58 de clustere de gene PA14 nu s-au corelat cu virulența acestor tulpini. Astfel, s-a ajuns la concluzia că virulența în P. aeruginosa este atât combinatorie, cât și multifactorială și că genele necesare pentru ca o tulpină să fie patogenă nu sunt necesare pentru virulență în alte tulpini (29).,

de Cercetare, de asemenea, face într-un laboratorul de microbiologie la Universitatea Loyola din Chicago, a ajuns la concluzia că Pseudomonas aeruginosa se dezvoltă un verzui/galben fluorescent pigment în bulion nutritiv și hidroliza cazeinei. După plasarea acestui pigment fluorescent sub lumină UV, am observat un pigment albastru / verde fluorescent în eprubetă. (35)
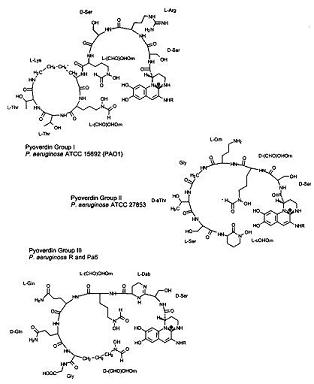
Sub un deficit de fier, galben-verde fluorescent pigment se dezvoltă ca urmare a pyoverdins, un termen numit de Turfreijer pentru un grup de compuși având o (1S)-5-amino-2,3-dihidro-8,9-dihidroxi-1H-pyrimido – chinolin-1-carboxilic acid cromofor. Figura 6A prezintă diferitele tipuri de grupe Pyoverdin care pot fi făcute pe variații ale lanțului lor peptidic. Acești compuși de pigment cresc numai sub limita fierului într-un mediu de creștere. Figura 6A prezintă cele trei subgrupe sv diferite de Pyoverdin de P. aeruginosa., Deoarece aceste trei pyoverdin structuri (de asemenea, cunoscut sub numele de ferri-pyoverdins) nu sunt produse de alte specii de Pseudomonas ele pot fi o modalitate rapidă de a identifica bacterii specifice, Pseudomonas aeruginos. (34)
1) Lederberg, Joshua și colab. Pseudomonas. Enciclopedia de Microbiologie. Ediția A Doua. Volumul 3. San Diego, 2000. p. 876-891.3) Botzenhardt, K. și Doring, G. ecologia și epidemiologia Pseudomonas aeruginosa. Pseudomonas aeruginosa ca agent patogen oportunist. 1993. p. 1-7.4) Fick, R., Pseudomonas aeruginosa—the Microbial Hyena and Its Role in Disease: An Introduciton. Pseudomonas aeruginosa: The Opportunist. 1993. p. 1-6.
5) National Center for Biotechnology Information site
6) Gilardi, G. Cultural and Biochemical Aspects for Identification of Glucose-Nonfermenting Gram-Negative Rods. Nonfermenting Gram-Negative Rods. 1985. p.17-24.
8) Craig, W., and Ebert, S. Antimirobial Therapy in Pseudomonas aeruginosa Infections. Pseudomonas aeruginosa Infections and Treatment. 1994. p. 470-491.
9) Pseudomonas Genome Database
11) P., aeruginosa PA14 Genomic Sequencing Project
13) Delden, C. Virulence Fators in Pseudomonas aeruginosa. Pseudomonas. 2004. p. 1-7.
14) Cox, C. Iron and the Virulence of Pseudomonas aeruginosa. Pseudomonas aeruginosa: The Opportunist. 1993. p. 41-45.
15) Rabaey, K., and Verstraete, W. „Microbial Fuel Cells: novel biotechnology for enegy generation”. TrendS in Biotechnology. 2005. Volume 23.
16) Rojo, F., and Dinamarca, A. Catabolite Repression and Physiological Control. Pseudomonas. 2004. p. 365-366.
17) Valls, M., Cases, I., and Lorenzo, V., Transcrierea mediată de promotorii dependenți de rpoN. Pseudomonas. 2004. p. 398-302.18) Centrul pentru Controlul și Prevenirea Bolilor
19) Centrul pentru ingineria biofilmelor
20) Brown, M. și Simith, A. agenți antimicrobieni și biofilme. Implicațiile medicale ale biofilmelor. 2003. p. 36-38.21) Irvin, Randall. Atașarea și colonizarea Pseudomonas aerugionsa: rolul structurilor de suprafață. Pseudomonas aeruginosa ca agent patogen oportunist. 1993. p. 19-36.22) Lowbury, E. Importanța biologică a Pseudomonas aeruginosa: Aspecte medicale., Genetica și biochimia Pseudomonas. 1975. p. 37-43.23) Holden, M., și Williams, P. „Quorum Sensing”. Enciclopedia științelor vieții. 2001.
25) Pieper, D., Stadler-Fritzche, K., Scholomann, M., și Knackmuss, H. Metabolismul acidului 2-Cloro-4-Methylphenoxyacetate de Alcaligenes eutrophus JMP 134: Implicații pentru Degradarea Cloro – Metil și s-a Substituit Aromatice prin orto Clivaj. Pseudomonas Biologie Moleculară și Biotehnologie. 1992. p. 268-272.,27) Administrația Națională de Aeronautică și spațiu
36) editată de studenți: Katie Bates și Ashley Mores de la M Glogowski la Universitatea Loyola. Lyczak, JB, tun, CL, Pier, GB. „Establishment of Pseudomonas aeruginosa infection: lessons from a versatile opportunist”. Microbi și infecții. 2000. Volumul 2. Ediție 9. p. 1051-1060.37) ” VetBact.”VetBact. N. p., n.d. Web.,
Scris de Chelsea Dao, un student de Rachel Larsen
Editat de KLB
Editate de către studenți: Vivek Brahmbhatt și Varun Garg / Michelle Chua și Safi Khan Maria Glogowski de la Loyola University, Irina Rojas și Aaron Deese la Colegiul Hamilton