Polar Covalent Bonds and Hydrogen Bonds
a covalent bond is the force of attraction that holds together two nonmetal atoms that share a pair of electrons. Um elétron é fornecido por cada átomo, e o par de elétrons é atraído para os núcleos positivos de ambos os átomos. A molécula de água representada na figura \(\PageIndex{4}\) contém ligações covalentes polares.a força atrativa entre as moléculas de água é uma interação dipolar., Os átomos de hidrogênio estão ligados ao átomo de oxigênio altamente eletronegativo (que também possui dois pares de elétrons isolados, o que faz com que uma ligação muito polar. O átomo de hidrogénio parcialmente positivo de uma molécula é então atraído para o átomo de oxigénio parcialmente negativo de uma molécula de água próxima (ver Figura \(\PageIndex{4}\) abaixo).
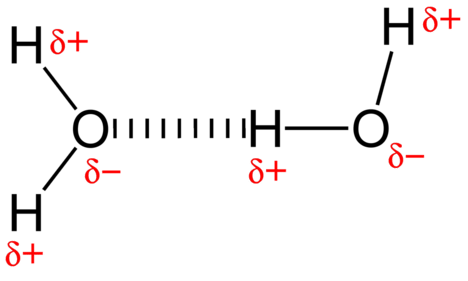
Uma ligação de hidrogênio é uma intermoleculares e intramolecular atraente vigor na qual um átomo de hidrogênio que está ligadas ligada a um altamente eletronegativos átomo é atraído para um solitário par de elétrons em um átomo ou parcialmente negativa do átomo vizinho molécula polar. Ligações de hidrogênio também são encontradas intramolecularmente na estrutura terciária e quaternária das proteínas e cadeias de DNA.,
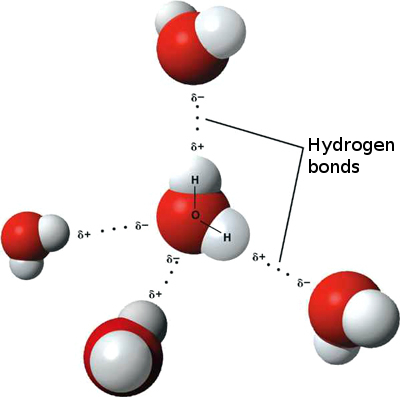
ligação de Hidrogênio ocorre apenas em moléculas onde o hidrogénio é ligadas ligado a um dos três elementos: flúor, oxigênio ou nitrogênio., Estes três elementos são tão eletronegativos que retiram a maioria da densidade de elétrons na ligação covalente com hidrogênio, deixando o átomo de H muito deficiente em elétrons. O átomo H quase atua como um próton, deixando-o muito atraído por pares de elétrons isolados em um átomo próximo.
a ligação do hidrogénio que ocorre na água leva a algumas propriedades incomuns, mas muito importantes. A maioria dos compostos moleculares que têm uma massa semelhante à água são gases à temperatura ambiente. Devido às fortes ligações de hidrogênio, as moléculas de água são capazes de permanecer condensadas no estado líquido., A figura \(\PageIndex{5}\) mostra como a forma dobrada e dois átomos de hidrogénio por molécula permitem que cada molécula de água seja capaz de ligar hidrogénio a duas outras moléculas.
no estado líquido, as ligações de hidrogénio da água podem quebrar-se e reformar-se à medida que as moléculas fluem de um lugar para outro. Quando a água é arrefecida, as moléculas começam a abrandar. Eventualmente, quando a água é congelada ao gelo, as ligações de hidrogénio formam uma rede muito específica (figura \(\PageIndex{6}\)).,
