enlaces covalentes polares y enlaces de hidrógeno
un enlace covalente es la fuerza de atracción que mantiene unidos a dos átomos no metálicos que comparten un par de electrones. Un electrón es proporcionado por cada átomo, y el par de electrones es atraído a los núcleos positivos de ambos átomos. La molécula de agua representada en la figura \(\PageIndex{4}\) contiene enlaces covalentes polares.
la fuerza de atracción entre las moléculas de agua es una interacción dipolar., Los átomos de hidrógeno están unidos al átomo de oxígeno altamente electronegativo (que también posee dos pares solitarios de electrones, creando un enlace muy polar. El átomo de hidrógeno parcialmente positivo de una molécula es atraído por el átomo de oxígeno parcialmente negativo de una molécula de agua cercana (Ver figura \(\PageIndex{4}\) a continuación).
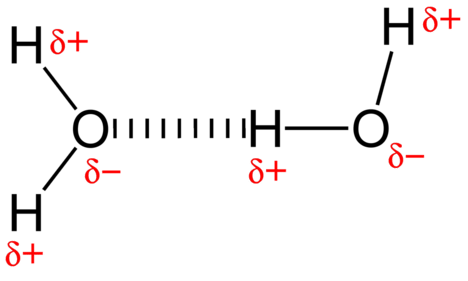
un enlace de hidrógeno es una fuerza de atracción intermolecular e intramolecular en la que un átomo de hidrógeno unido covalentemente a un átomo altamente electronegativo es atraído por un par solitario de electrones en un átomo o un átomo parcialmente negativo en una molécula polar vecina. Los enlaces de hidrógeno también se encuentran intramolecularmente en la estructura terciaria y cuaternaria de las hebras de proteínas y ADN.,
el enlace de hidrógeno ocurre solo en moléculas donde el hidrógeno está unido covalentemente a uno de tres elementos: flúor, oxígeno o nitrógeno., Estos tres elementos son tan electronegativos que retiran la mayor parte de la densidad electrónica en el enlace covalente con el hidrógeno, dejando al átomo H muy deficiente en electrones. El átomo H casi actúa como un protón Desnudo, dejándolo muy atraído por los electrones del par solitario en un átomo cercano.
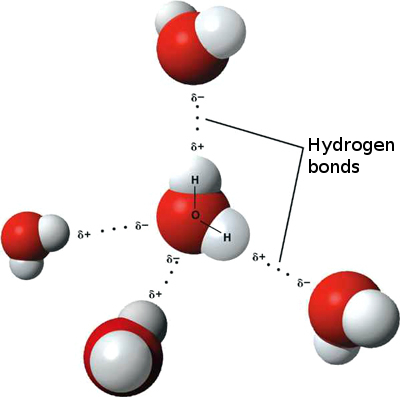
el enlace de hidrógeno que se produce en el agua conduce a algunas propiedades inusuales, pero muy importantes. La mayoría de los compuestos moleculares que tienen una masa similar al agua son gases a temperatura ambiente. Debido a los fuertes enlaces de hidrógeno, las moléculas de agua pueden permanecer condensadas en estado líquido., La figura \(\PageIndex{5}\) muestra cómo la forma doblada y dos átomos de hidrógeno por molécula permiten que cada molécula de agua pueda unirse a otras dos moléculas.
en el estado líquido, los enlaces de hidrógeno del agua pueden romperse y reformarse a medida que las moléculas fluyen de un lugar a otro. Cuando el agua se enfría, las moléculas comienzan a ralentizarse. Eventualmente, cuando el agua se congela, los enlaces de hidrógeno forman una red muy específica (figura \(\PageIndex{6}\)).,
