 général
général
le Hafnium est un élément chimique portant le symbole Hf et le numéro atomique 72. Il est nommé d’après le nom Latin de la ville de Copenhague, Hafniain dont l’élément a été découvert. C’est un métal de transition gris argenté, brillant et résistant à la corrosion qui se trouve dans le 4ème Sous-Groupe (Groupe 4) ou le groupe Titane dans le tableau périodique.,
L’Hafnium a des propriétés très similaires au zirconium directement au-dessus dans le tableau périodique. Les fonctions biologiques ne sont pas connues, il ne se produit normalement pas dans l’organisme humain et il n’est pas toxique.
L’Hafnium était l’un des derniers éléments stables du tableau périodique à être découvert. La première indication de l’existence d’un autre élément entre le lutétium et le tantale provient de la loi de Moseley trouvée en 1912., En 1914, Henry Moseley a tenté de trouver l’élément inconnu mais attendu avec le numéro atomique 72 selon cette loi dans des échantillons de minéraux de terres rares (aujourd’hui lanthanides). Mais il a échoué.
dans ses travaux sur la théorie atomique publiés en 1922, Niels Bohr prédit que la série des lanthanides avec le lutétium prendrait fin et que l’élément 72 devait donc être similaire au zirconium. L’Hafnium a pu être détecté un an plus tard: en 1923, Dirk Coster et George de Hevesy l’ont découvert à Copenhague en utilisant la spectroscopie des rayons X dans le zirconium Norvégien., Une étude plus approfondie d’autres minéraux a montré que l’hafnium est toujours contenu dans des minéraux contenant du zirconium. Jantzen et Hevesy ont réussi à les séparer du zirconium en cristallisant à plusieurs reprises les fluorures de diammonium et de dipotassium des deux éléments. L’hafnium élémentaire pourrait alors être obtenu par réduction avec du sodium.
événement
Hafnium, avec un contenu de 4,9 ppm dans la croûte continentale, est un élément qui n’est pas très commun sur terre., En termes de fréquence, il est comparable aux éléments brome et césium et plus commun que l’or et le mercure connus depuis longtemps. Hafnium ne se produit pas naturellement ou dans ses propres minéraux. Les minéraux de Zirconium tels que le zircon et la baddeleyite, en revanche, contiennent toujours de l’hafnium; la quantité d’hafnium est généralement de 2% de la teneur en zirconium (1 à 5% en poids d’hafnium). L’un des rares minéraux qui contiennent plus d’hafnium que de zirconium est la variété de zircon Alvit .,
analogues au zirconium, les gisements d’hafnium les plus importants sont les gisements de zirconium en Australie et en Afrique du Sud. Les réserves sont estimées à 1,1 million de tonnes (calculées en oxyde d’hafnium).
Extraction et de présentation
afin d’obtenir de l’hafnium, il doit être séparé de la zirconium. Cela n’est pas possible pendant le processus de fabrication, mais se déroule dans un processus séparé. Les processus d’Extraction sont utilisés pour la séparation., La solubilité différente de certains sels de zirconium et d’hafnium dans des solvants spéciaux est utilisée. Des exemples de ceci sont les différentes solubilités des nitrates dans le phosphate de tri-n-butyle et celle des thiocyanates dans l’isobutylcétone méthylique. D’autres options de séparation possibles sont les échangeurs d’ions et la distillation fractionnée de composés appropriés.
après le procédé Kroll, l’hafnium séparé peut d’abord être converti en chlorure d’hafnium (IV), puis réduit en hafnium élémentaire avec du sodium ou du magnésium.,
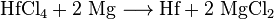
si un hafnium encore plus pur est requis, le procédé Van Arkel De Boer peut être utilisé. Pendant le chauffage sous vide, l’hafnium réagit initialement avec l’iode pour former de l’iodure d’hafnium (IV). Ceci est à nouveau décomposé en hafnium et en iode sur un fil chaud.

Hafnium est produite seulement en petites quantités sur une échelle de 100 tonnes., Il n’est pas produit en interne, mais est un sous-produit de l’extraction du zirconium sans hafnium pour les barres de combustible.
Propriétés
Propriétés Physiques

la structure Cristalline de l’α-Hf, a = 320 h,c = 505 h
Hafnium est un argenté, brillant, en métal lourd de haute densité (13,31 g / cm3). Il cristallise en deux modifications différentes en fonction de la température., Dans des conditions normales, il cristallise dans un emballage hexagonal fermé de sphères (α-Hf) et est donc isotypique à α-Zr, au-dessus de 1775 ° C, il se transforme en une structure cubique centrée sur le corps (β-Hf).
si la pureté de l’hafnium est élevée, il est relativement doux et souple. Il est facile de travailler en roulant, en forgeant et en martelant. Si, en revanche, il y a des traces d’oxygène, d’azote ou de carbone dans le matériau, il devient fragile et difficile à traiter., Les points de fusion et d’ébullition de l’hafnium sont les plus élevés du groupe à 2227 ° C et 4450 ° C (Point de fusion: titane: 1667 ° c, zirconium: 1857 ° c).
dans presque toutes les autres propriétés, le métal ressemble à son homologue plus léger, le zirconium. Ceci est causé par la contraction des lanthanides, qui provoque des rayons atomiques et ioniques similaires (rayons atomiques Zr: 159 pm, Hf: 156 pm). Une exception est la densité du zirconium avec 6,5 g / cm3 a une valeur significativement plus faible. Une différence techniquement importante est que l’hafnium peut absorber les neutrons 600 fois mieux., C’est la raison pour laquelle le hafnium doit être séparé pour l’utilisation du zirconium dans les centrales nucléaires.
L’Hafnium est supraconducteur en dessous de la température de transition de 0,08 K.
propriétés chimiques
L’Hafnium est un métal de base qui réagit avec l’oxygène pour former du dioxyde d’hafnium lorsqu’il est chauffé. D’autres non-métaux, tels que l’azote, le carbone, le bore et le silicium, forment également des composés dans ces conditions., Une couche d’oxyde dense se forme rapidement à température ambiante, ce qui passive le métal et le protège de toute oxydation ultérieure.
L’Hafnium est stable dans la plupart des acides en raison de sa passivation dans des conditions normales. Il se corrode rapidement dans l’acide fluorhydrique; la corrosion notable se produit dans l’acide sulfurique et phosphorique chaud et concentré. Les mélanges acide chlorhydrique-acide nitrique, y compris l’eau régale, ne doivent être exposés à l’hafnium que pendant une courte période, même à température ambiante; à 35 ° C, des taux d’élimination supérieurs à 3 mm / an doivent être attendus., Dans les bases aqueuses, il résiste jusqu’à une température d’env. 100 ° C, l’enlèvement de matière est généralement inférieur à 0,1 mm / an.
isotope
il y a un total de 35 isotopes et 18 isomères nucléaires de hafnium 153hf à 188hf connus. Hafnium naturel est un élément mixte qui se compose d’un total de six isotopes différents. L’isotope le plus commun est avec une fréquence de 35,08% 180Hf. Il suit 178Hf avec 27,28%, 177hf avec 18,61%, 179hf avec 13,62%, 176hf avec 5,27% et 174hf à 0,16%., Le seul isotope naturel est 174hf faiblement radioactif, c’est un émetteur alpha avec une demi-vie de 2 x 1015 ans. Les isotopes 177Hf et 179hf peuvent être détectés à l’aide de la spectroscopie RMN.
l’isomère du noyau 178 2mavec une demi-vie de 31 ans, Hf a une longue durée de vie et émet en même temps un fort rayonnement gamma de 2,45 MeV lorsqu’il se désintègre. C’est l’énergie la plus élevée qu’un isotope stable sur une longue période de temps émet. Une application possible consiste à utiliser cet isomère de base comme source dans des lasers puissants., En 1999, Carl Collins a découvert que l’isomère pouvait libérer son énergie d’un seul coup lorsqu’il était exposé aux rayons X. Cependant, les applications possibles, telles que les explosifs, sont peu probables.
Utilisation
Hafnium feuille de déchets industriels
Parce qu’il est difficile d’extraire, de hafnium est seulement utilisé en petites quantités. Le principal domaine d’application est la technologie nucléaire, dans laquelle l’hafnium est utilisé comme tige de commande pour réguler la réaction en chaîne dans les réacteurs nucléaires., L’utilisation de l’hafnium présente plusieurs avantages par rapport à d’autres substances susceptibles d’absorber des neutrons. L’élément est très résistant à la corrosion et la réaction nucléaire avec les neutrons crée des isotopes de hafnium, qui ont également des sections efficaces d’absorption élevées. En raison de son prix élevé, il ne convient souvent que pour des applications militaires, par exemple pour les réacteurs des sous-marins atomiques.
Il y a quelques autres utilisations., L’Hafnium réagit rapidement avec de petites quantités d’oxygène et d’azote et peut donc être utilisé comme substance getter pour éliminer les plus petites quantités de ces substances des systèmes de vide ultra-poussé. Lorsqu’il est brûlé, le métal émet une lumière très brillante. Il est donc possible d’utiliser du hafnium dans des lampes flash avec un rendement lumineux particulièrement élevé. Plusieurs composés très stables et à fusion élevée, en particulier le nitrure d’hafnium et le carbure d’hafnium, peuvent être fabriqués à partir des éléments.,
dans les alliages avec des métaux tels que le niobium, le tantale, le molybdène et le tungstène, une addition de 2% d’hafnium augmente la résistance. Des matériaux particulièrement stables, à fusion élevée et résistants à la chaleur sont créés.
consignes de sécurité
comme beaucoup d’autres métaux, l’hafnium est hautement inflammable et pyrophorique dans son état finement divisé. En revanche, il n’est pas inflammable lorsque compact. Le métal n’est pas toxique. Pour ces raisons, aucune règle de sécurité particulière ne doit être respectée lors de la manipulation du hafnium.,
Connexions
Hafnium forme un certain nombre de composés. Ce sont principalement des sels ou des cristaux mélangés et ont souvent des points de fusion élevés. L’état d’oxydation le plus important de l’hafnium est + IV, mais des composés dans des États d’oxydation inférieurs, de 0 à + III, et dans des complexes également des États d’oxydation négatifs sont connus.
oxyde D’Hafnium (IV)
L’oxyde D’Hafnium (IV) est un solide très stable et à fusion élevée. Il a une permittivité relative élevée de 25 (à titre de comparaison: dioxyde de silicium: 3,9)., Il peut donc être utilisé comme diélectrique high-k pour isoler la connexion de contrôle (gate) des microprocesseurs. En réduisant encore les largeurs de structure, les courants de fuite deviennent un problème de plus en plus important, car la miniaturisation des structures CMOS nécessite également une isolation de grille plus mince. Le courant de fuite indésirable augmente fortement en dessous de 2 nm en raison de l’effet tunnel. En utilisant un diélectrique à k élevé, l’épaisseur du diélectrique peut être augmentée à nouveau afin de réduire le courant de fuite sans que le transistor présente une perte de performance (réduction de la vitesse de commutation)., Ainsi, des diélectriques plus épais permettent une miniaturisation supplémentaire.
Autres composés d’hafnium
carbure d’Hafnium est l’une des substances les plus hauts points de fusion. Avec le nitrure d’hafnium et le borure d’hafnium, il appartient aux matériaux durs.
il existe des composés halogènes connus de l’hafnium. Dans l’état d’oxydation + IV existent à la fois le fluorure et le chlorure, le bromure et l’iodure. Le chlorure d’Hafnium (IV) et l’iodure d’hafnium (IV) jouent un rôle dans la production d’hafnium., Dans les États d’oxydation inférieurs, seuls les composés de chlore et de brome et l’iodure d’hafnium (III) sont connus.
l’hexafluoridohafnate de potassium (IV) K2 ainsi que l’hexafluoridohafnate d’ammonium (IV) (NH4)2 peuvent être utilisés pour séparer l’hafnium du zirconium, car les deux sels sont plus solubles que les complexes de zirconium correspondants.,
→ Hf + 2 H2O)
| isotope | NH | t1/2 | ZA | ZE (MeV) | ZP |
|---|---|---|---|---|---|
| 174Hf | 0,162% | 2 · 1015 a | α | 2,495 | 170Yb |
| 175Hf | {Syn.,r
Light- (F)
|
||||
| R and S phrases | R: 17 | ||||
| S: no phrases |
